Слайд 2

Алюминий туралы мәлімет
Алюминий (лат. Aluminium),– ашудас, Al – элементтердің периодтық жүйесінің
ІІІ тобындағы химиялық элемент, рет нөмірі 13, атомдық массасы 26,9815. Бір тұрақты изотопы бар. Жер қыртысында таралуы бойынша элементтер арасында 4, металдар арасында 1-ші орында. Табиғатта жүздеген минералдары кездеседі, оның көпшілігі – алюмосиликаттар болып келеді.
Слайд 3

Алюминий ашылуы
Алюминий алғашқы рет 1825 ж. Даниялық физик Ханс Оерстедпен алюминий
хлоридіндегі калий амальгамымен әрекеттесіп, содан кейін сынаптың дистилденуімен алынды. Алюминийді өндірудің индустриялық электролиттік әдісін әзірлеуден бұрын, бұл металл алтыннан қымбат болды.
Слайд 4

Алынуы
Алюминий өндірісінде, шикізат ретінде көбінесе бокситтер Al2O3 *xH2O жиі қолданылады. Қақтағанда,олар
суын жоғалтып ,алюминий оксидіне айналады.
Электролиз кезінде катода алюминий, ал анодта оттек бөлінеді.Электролиз реакциясының жалпы теңдеуі:
2Al2O3 → 4Al+3O2
*Елімізде Павлодар қаласында Торғай кен орнындағы бокситтен электролиздік әдіс арқылы алюминийді алу үшін глинозем өндіретін алюминий зауыты жұмыс істейді. Металл күйіндегі алюминий алынатын электролиз цехтары салынып, 2007 жылдан өнім бере бастады.
Слайд 5

Физикалық қасиеттері
Алюминий күмістей ақ түсті жеңіл металл. Алюминийдің иілгіштік қасиеті жоғары,ол
оңай фольга болып жайылады және сым түріне созылады. Алюминий электрөткізгіштігі мен жылуөткізгіштігі жоғары металл.
Слайд 6

Химиялық қасиеттері
Ауада алюминий оттекпен әрекеттесіп,оны қорғайтын оксидтік қабықша түзеді.Қабықшасы алынған алюминий
өте белсенді.Сынаппен алюминий құймасы амальгама түзеді
Алюминий ұнтағын қыздырғанда тұтанады және оксидін түзіп, жарық жалынымен жанады
4Al+3O2=2Al2O3 H= -3350кДж
Алюминий мен оттектің байланысы өте жоғары беріктілікпен ерекшеленеді.Сондықтан алюминий көптеген металл оксидтерін (темір,марганец,хром) оттекті тартып алады. Металл оксидтерін алюминиймен тотықсыздандыру үшін алюмотермия деп аталады. Мысалы,егер алюминий ұнтағын темір оксидімен Fe3O4 немесе FeO*Fe2O3 араластырып қоспаны жақса, онда өте қарқынды реакция жүреді:
8Al+3FeO* Fe2O3=4Al2O3+9Fe H=3240кДж
Слайд 7

Химиялық қасиеттері
Алюминий галогендермен тікелей әрекеттесіп, галогенидтер түзеді:
2Al+3Br2=2AlBr3
Слайд 8

Егер қорғағыш қабықшаны химиялық әдіспен аластатса (мысалы,сілті ерітіндісімен),онда металл сумен сутекті
бөліп,қарқынды әрекеттеседі:
2Al+6H2O=2Al(OH)3+3H2
Сұйылтылған тұз және күкірт қышқылдары оксид қабықшасын бұзып,сутекті ығыстырып, алюминийді оңай ерітеді:
2Al+6HCl=2AlCl3+3H2
Екідайлы болғандықтан алюминий сілті ерітінділерімен де оңай әрекеттеседі:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
Сұйылтылған азот қышқылы алюминиймен әректтесіп азот (II) оксидіне дейін тотықсызданады:
2Al+4HNO3=Al(NO3)3+NO +2H2O
Суықта концентірлі азот және күкірт қыщқылдарында алюминий қорғағыш қабықша түзілу нәтежесінде енжарланады.Сондықтан азот қышқылын алюминий ыдыстарында сақтайды және тасымалдайды.
Слайд 9

Алюминий оксиді
Al2O3 қиын балқитын, ақ түсті қатты зат. Табиғатта корунд
минералы түрінде кездеседі. Алюминий оксиді суда ерімейді, бірақ қышқылда жақсы ериді;
Al2O3 + 6HCl=2AlCl3+3H2O
Сілті ерітінділерімен гидроксоалюминаттар түзеді:
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
ал құрғақ сілтілермен балқытқанда, метаалюминаттар береді
Al2O3+2NaOH=2NaAlO2+H2O
Алюминий гидроксидінің Al (OH)3 екі түрлі түрөзгерісі болуы мүмкін:кристалдық немесе аморфтық.
Слайд 10

Алюминий гидроксидінің Al (OH)3 екі түрлі түрөзгерісі болуы мүмкін:кристалдық немесе аморфтық.
Алюминий
гидроксдін алюминий тұздары ертінділеріне сілтімен әсер ету арқылы алынады :
AlCl3+3NaOH = Al(OH)3 +3NaCl
Жаңа тұнған Al(OH)3 ақ қоймалжың тұнба, суда мүлдем ерімейді және типтік екідайлы гирдоксид болып табылады:
Al(OH)3+3HCl=АlCl3+3H2O
Al(OH) 3+NaOH=Na[Al(OH)4]
Алюминий тұздары сулы ерітінділерде жоғары дәрежеде гидролизге ұшырайды:
AlCl3+HOH → Al(OH)Cl2+HCl
Алюминийдің әлсіз қышқылдармен түзетін тұздары сулы ертінділерде толық гидролизге ұшырайды:
Al2S3+6HOH=2Al(OH)3 +3H2S
Слайд 11
Слайд 12

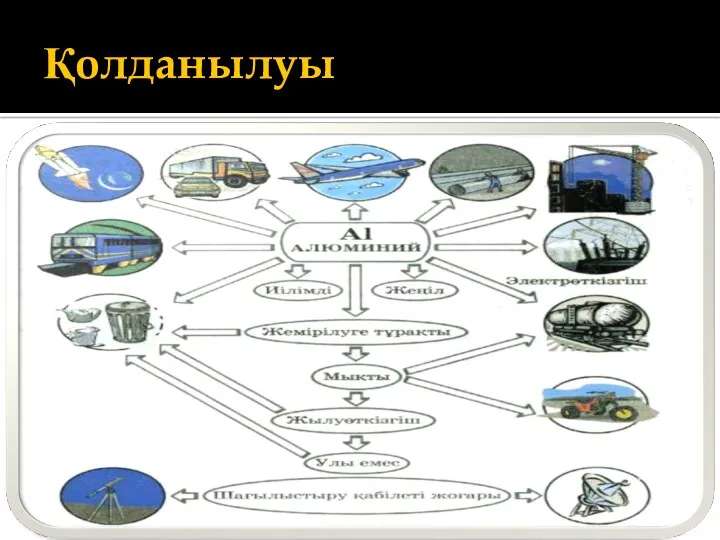
Қолданылуы
Алюминий техникада және тұрмыста кеңінен қолданады. Жеңіл және бағалы қасиеттері бар
құймалар алынатындықтан,оның авиациялық өнеркәсіпте, автокөлікте ,электротехникада электр сымдарын жасауда маңызы өте зор.
Корунд Al2 О3 – зергерлік өнеркәсіпте мойын тіректер мен тіректер, қоспалар әсерінен әртүрлі бағалы тастар (рубин сапфир және аметист)
Алюминий хлориді AlCl3 органикалық синтезде өршіткі ретінде.
Алюминий сульфаты (Al2(SO4)3) - суды тазарту, қағаз өндіру.
Алюминий кристаллогидраты Al2(SO4)3 18H2O –мақта маталарды бояуға . Алюмокали ашудасы KAl(SO4)2 12H2O –тері ,аяқкиім өнеркәсібінде тері илегенде және маталарды бояуда.











 Чисті речовини і суміші
Чисті речовини і суміші Oxygen, O2
Oxygen, O2 Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) В мире криссталлов
В мире криссталлов Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка Классификация органических соединений
Классификация органических соединений Классификация дисперсных систем
Классификация дисперсных систем Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Железо и его соединения
Железо и его соединения Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Галогены
Галогены Природные источники углеводородов
Природные источники углеводородов Виды химической связи
Виды химической связи Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Закон сохранения массы веществ
Закон сохранения массы веществ Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Электрохимическая защита
Электрохимическая защита Соединения кремния
Соединения кремния Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Алкадиены
Алкадиены Геометрическая кристаллография
Геометрическая кристаллография Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина Ионные уравнения
Ионные уравнения Йод в нашей жизни
Йод в нашей жизни Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Понятие биогенности химических элементов
Понятие биогенности химических элементов