Содержание
- 2. Актуальность Элементы, необходимые для построения и жизнедеятельности клеток и организмов, называют биогенными элементами. К жизненно необходимым
- 3. Актуальность Основу всех живых систем составляют шесть элементов: углерод, водород, кислород, азот, фосфор, сера, получивших название
- 4. Цель лекции Показать подход для изучения свойств биогенных элементов, исходя из представления об электронном строении атома
- 5. План лекции Актуальность темы Электронные конфигурации атомов биогенных элементов Гибридизация атомных орбиталей Ковалентные связи σ- и
- 6. Атомная орбиталь (АО) АО - это область пространства в окрестности ядра, где имеется максимальная вероятность (95
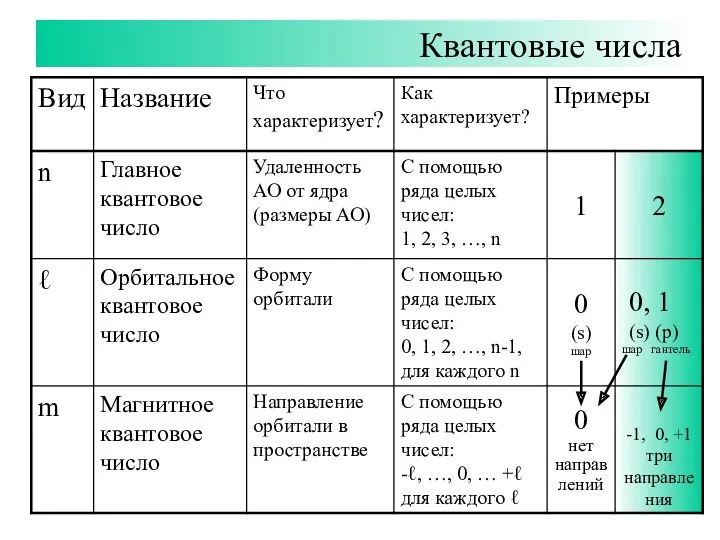
- 7. Квантовые числа
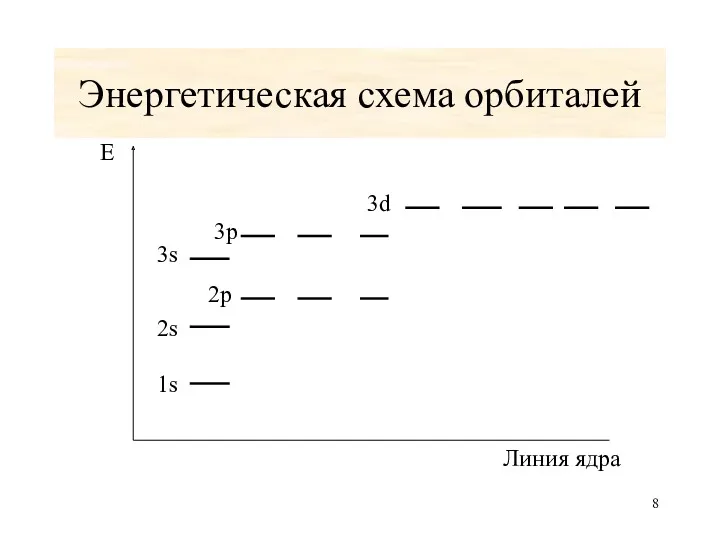
- 8. Энергетическая схема орбиталей
- 9. Заселение орбиталей электронами – в соответствии с тремя принципами Принцип Паули (запрет Паули) Принцип Гунда (запрет
- 10. Принцип наименьшей энергии (правило Клечковского) Электроны заселяют орбитали так, чтобы их общая энергия была минимальной. Общая
- 11. Проскоки (провалы) электронов При заселении d (или f)-орбиталей устойчивым считается состояние, при котором эти d (или
- 12. Примеры проскоков Так, у атома хрома, согласно принципам заселения, электронная конфигурация внешнего валентного уровня должна была
- 13. продолжаем Аналогично, электронная конфигурация внешнего валентного уровня атома меди должна быть Cu – 3d94s2. На самом
- 14. Валентные электроны Валентные электроны – это электроны внешнего уровня и незавершенного предвнешнего подуровня. Именно эти электроны
- 15. Конфигурации валентных электронов атома также определяются положением элемента в таблице Менделеева. При этом используются: - номер
- 16. Примеры: С – 2s22p2 n = 2 p-элемент, 2-я позиция, IV-группа
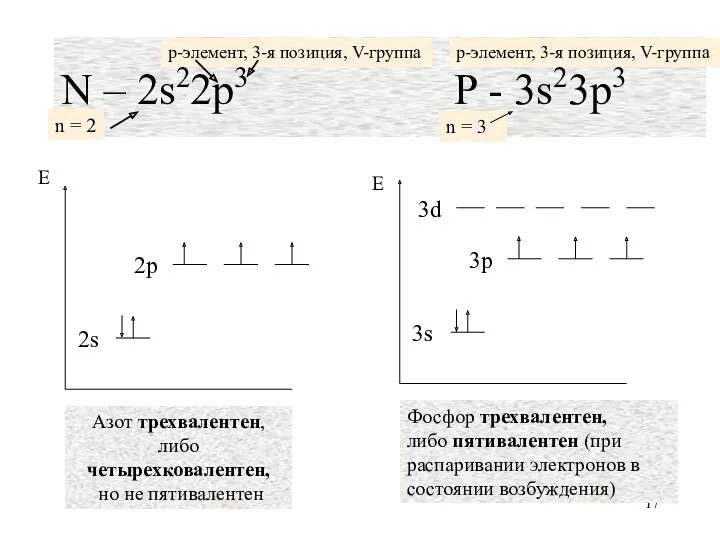
- 17. N – 2s22p3 P - 3s23p3
- 18. Са – 4s2 Са2+ – (4s0) АО валентного уровня вакантны и могут принимать атомы – доноры
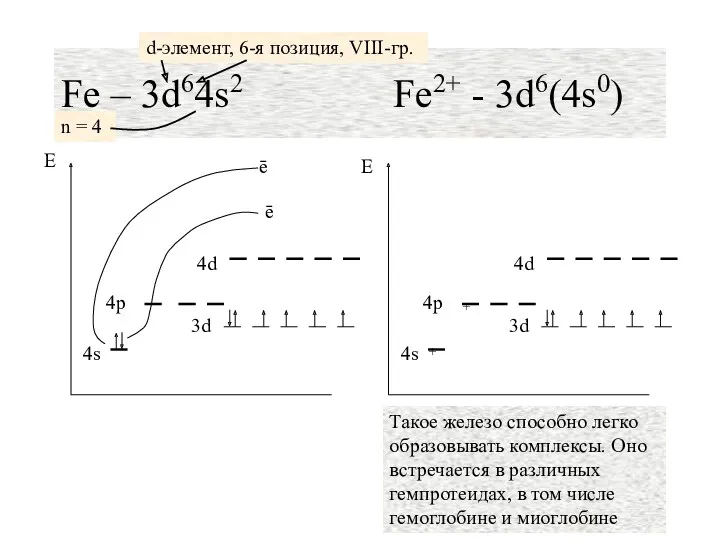
- 19. Fe – 3d64s2 Fe2+ - 3d6(4s0) n = 4 d-элемент, 6-я позиция, VIII-гр.
- 20. Химическая связь Это электростатическое взаимодействие между атомами с участием валентных электронов, сопровождающее выделением энергии от 20
- 21. Ⅰ группа Ⅱ группа Ионная Ковалентная Металлическая Ионная связь возникает между двумя противоположно заряженными частицами –
- 22. Ковалентная связь Это связь с помощью пары электронов, общих для обоих атомов. Причина образования ковалентной связи
- 23. Метод ВС Ковалентная связь образуется путем перекрывания двух валентных АО атомов-партнеров так, что в общее пользование
- 24. продолжаем Если же в перекрывание вступает двухэлектронная АО одного атома и вакантная АО другого атома, то
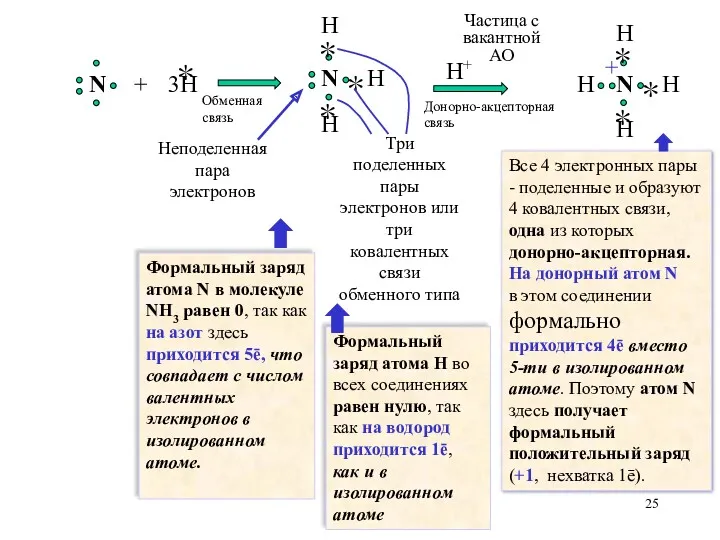
- 25. H Неподеленная пара электронов Три поделенных пары электронов или три ковалентных связи обменного типа Частица с
- 26. Итак, образование донорно-акцепторной связи в катионе аммония, в отличие от образования обменной связи, приводит к изменению
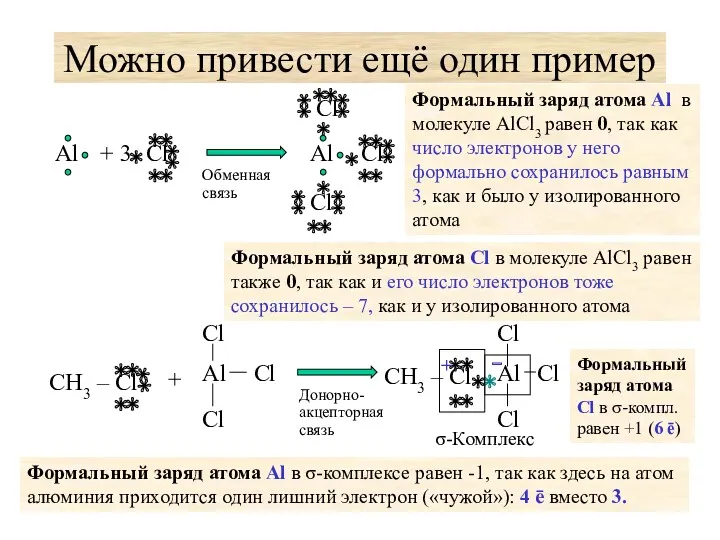
- 27. Можно привести ещё один пример Формальный заряд атома Cl в молекуле AlCl3 равен также 0, так
- 28. Гибридизация АО Гибридизация – это смешивание АО разной формы, а значит и энергии (в пределах валентного
- 29. Наиболее распространенные типы гибридизации АО
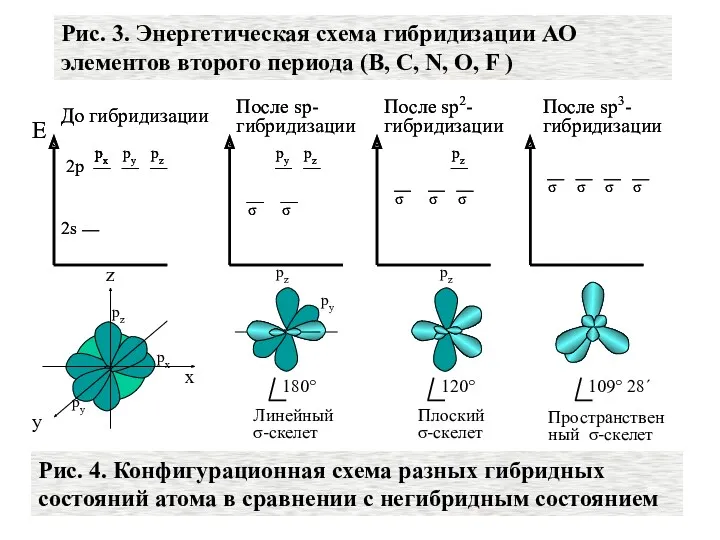
- 30. Рис. 3. Энергетическая схема гибридизации АО элементов второго периода (В, С, N, О, F ) Е
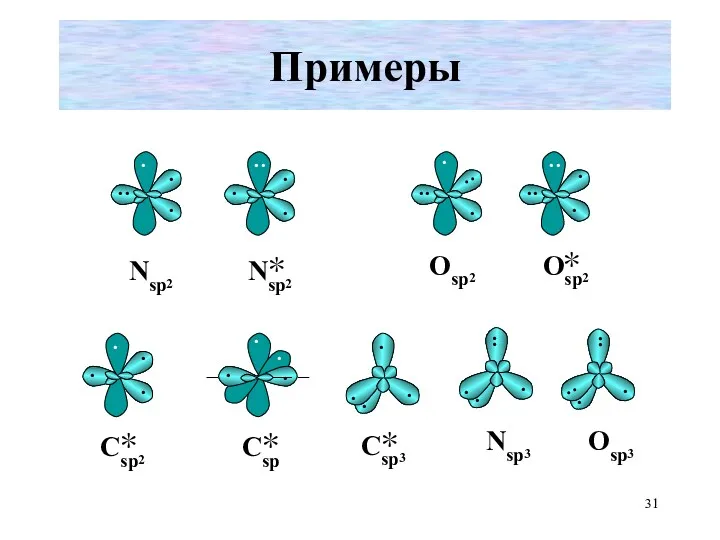
- 31. Примеры
- 32. Где встречаются такие атомы? Для прогнозирования структуры молекул на основе заданной гибридизации атомов можно воспользоваться несколькими
- 33. Однако при определенных условиях несвязывающие АО могут вступить в связь : При наличии в окружающей среде
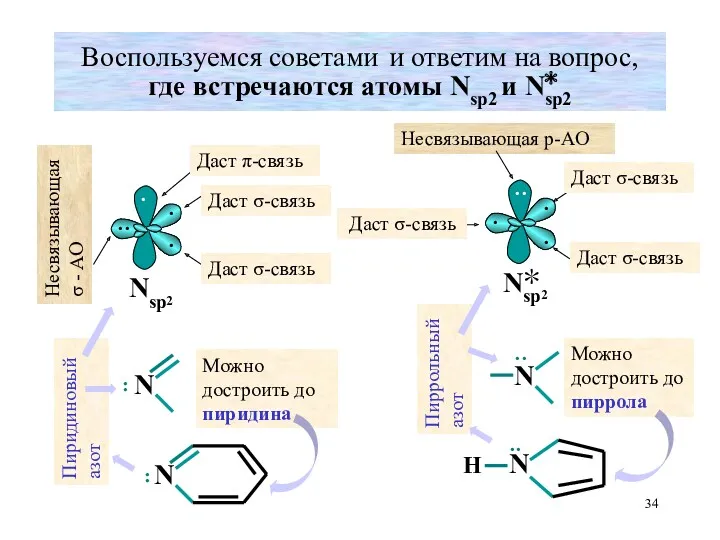
- 34. Воспользуемся советами и ответим на вопрос, где встречаются атомы Nsp2 и Nsp2 · · ·· ·
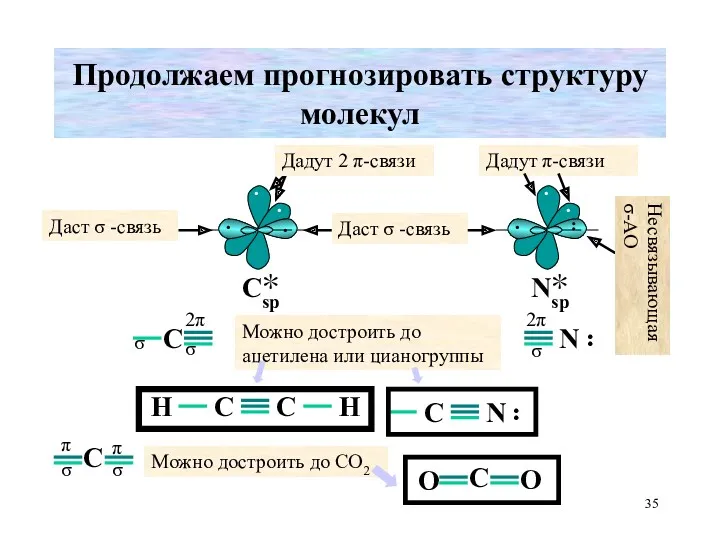
- 35. Продолжаем прогнозировать структуру молекул Дадут 2 π-связи Даст σ -связь Даст σ -связь Можно достроить до
- 36. Определение типа гибридизации Тип гибридизации атома в молекуле определяют с помощью различных спектральных методов. Однако в
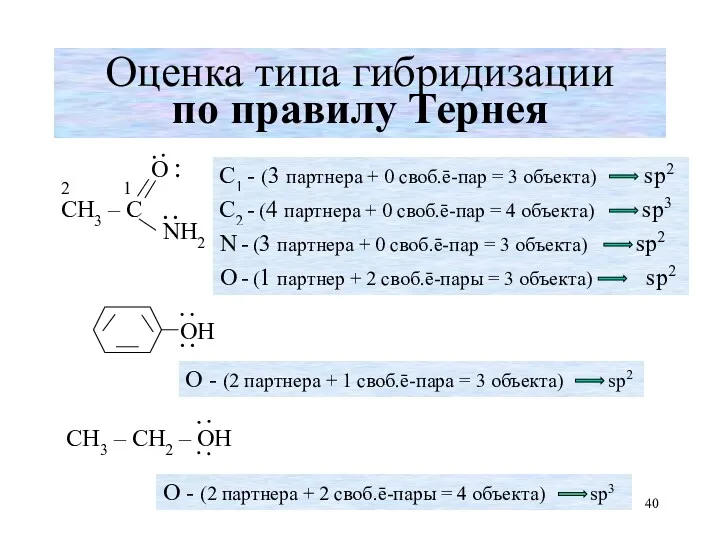
- 37. Под объектами понимают Число соседних атомов (партнёров) Число свободных (неподеленных никаким образом) электронных пар Электронная пара
- 38. Примеры атомов со свободными электронными парами Свободные электронные пары атомов азота, кислорода, серы (будут находиться на
- 39. В противном случае, т.е. если ни один из критериев не проходит, имеющаяся у атома электронная пара
- 40. Оценка типа гибридизации по правилу Тернея ∙ ∙
- 41. Ковалентные связи σ- и π-типа В зависимости от способа и симметрии перекрывания АО ковалентные связи бывают
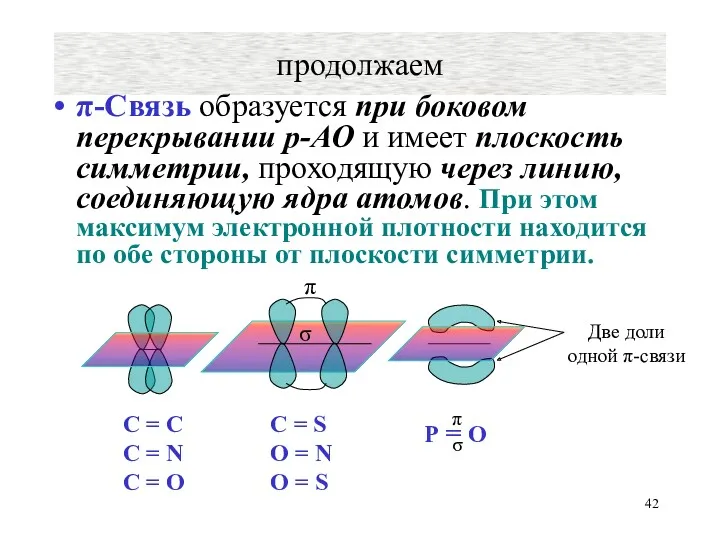
- 42. продолжаем π-Связь образуется при боковом перекрывании р-АО и имеет плоскость симметрии, проходящую через линию, соединяющую ядра
- 43. # Встречается и другой тип π-связи – c боковым перекрыванием орбиталей p – d ; d
- 44. Общие свойства ковалентной связи В отличие от большинства других типов связей, ковалентная связь характеризуется: Высокой прочностью
- 45. Основные выводы Большинство биогенных элементов сосредоточено в трех первых периодах таблицы Менделеева. По положению их в
- 46. Литература Основная: Слесарев В.И. – Химия: Основы химии живого: Учебник для вузов.– 3-е изд., испр. –
- 47. Литература Дополнительная: Грандберг И.И. – Органическая химия: Учеб. Для студ. вузов, обучающихся по агроном. спец. –
- 48. Внимание! Приготовиться к вопросу Пиррол Пирролидин Пиридин Пиперидин
- 50. Скачать презентацию



































 Кристаллические решетки
Кристаллические решетки Природные источники углеводородов
Природные источники углеводородов Щелочноземельные металлы
Щелочноземельные металлы NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Получение пресной и чистой воды
Получение пресной и чистой воды Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Спирты
Спирты циклоалканы170
циклоалканы170 Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Качественные реакции на органические вещества
Качественные реакции на органические вещества Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Амфотерные соединения
Амфотерные соединения Аспирин: польза или вред?
Аспирин: польза или вред? Опасности среды обитания человека
Опасности среды обитания человека Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Күрделі эфирлер
Күрделі эфирлер Валентність хімічних елементів
Валентність хімічних елементів Сложные эфиры. Жиры
Сложные эфиры. Жиры Биоорганическая химия
Биоорганическая химия Основные классы неорганических соединений
Основные классы неорганических соединений Соляная кислота. Хлориды
Соляная кислота. Хлориды Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Методы в химии
Методы в химии Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Железо. Физические свойства
Железо. Физические свойства Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов