Содержание
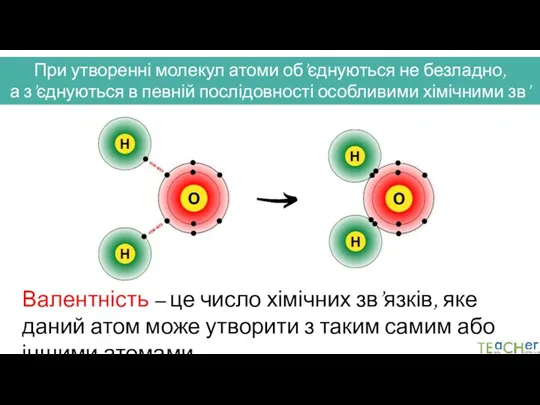
- 2. При утворенні молекул атоми об’єднуються не безладно, а з’єднуються в певній послідовності особливими хімічними зв’язками Валентність
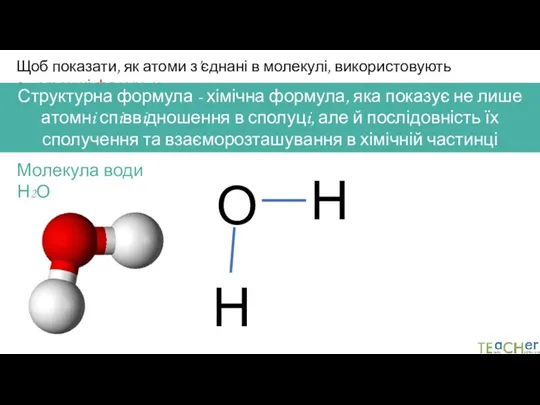
- 3. Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули Структурна формула - хімічна формула, яка
- 4. Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули Структурна формула - хімічна формула, яка
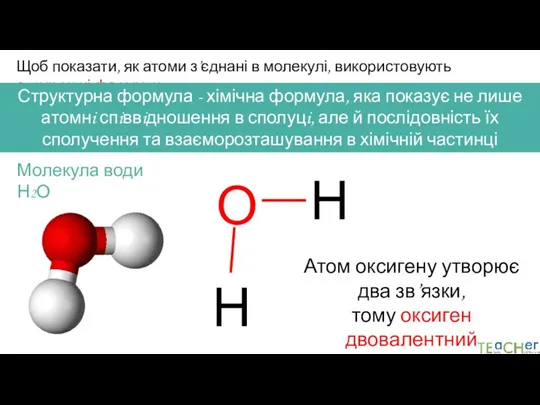
- 5. Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули Структурна формула - хімічна формула, яка
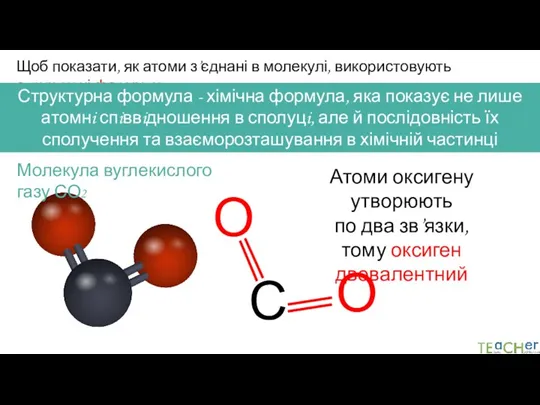
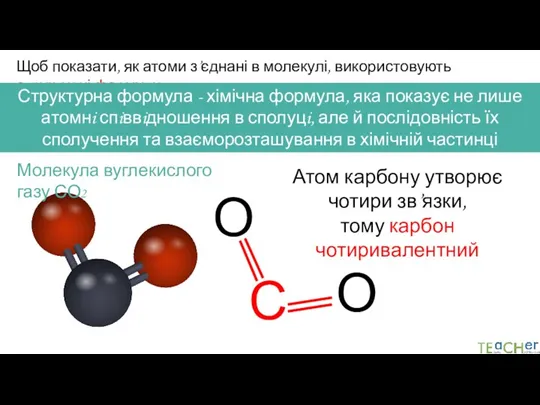
- 6. Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули Структурна формула - хімічна формула, яка
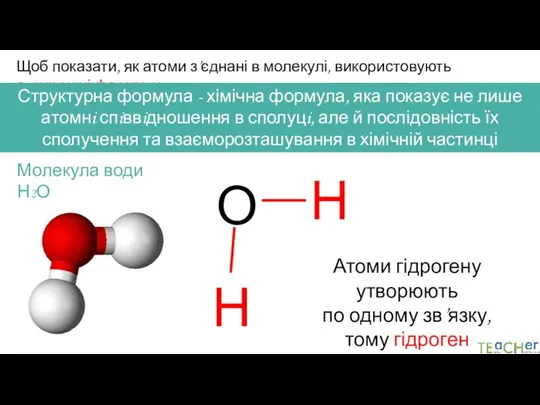
- 7. Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули Структурна формула - хімічна формула, яка
- 8. Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули Структурна формула - хімічна формула, яка
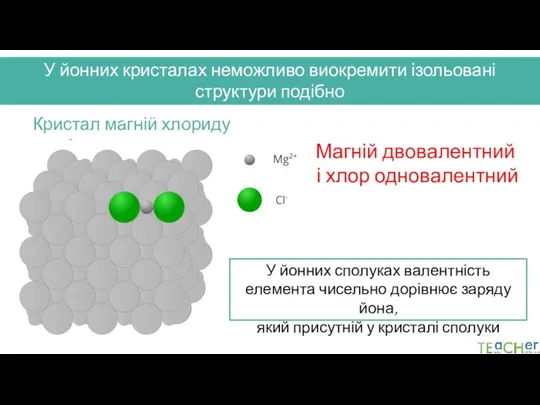
- 9. У йонних кристалах неможливо виокремити ізольовані структури подібно до молекул, тому їх неможливо описати за допомогою
- 10. Магній двовалентний і хлор одновалентний Кристал магній хлориду MgCl2 У йонних кристалах неможливо виокремити ізольовані структури
- 11. Деякі елементи проявляють сталу валентність, інші елементи проявляють різну валентність у різних сполуках
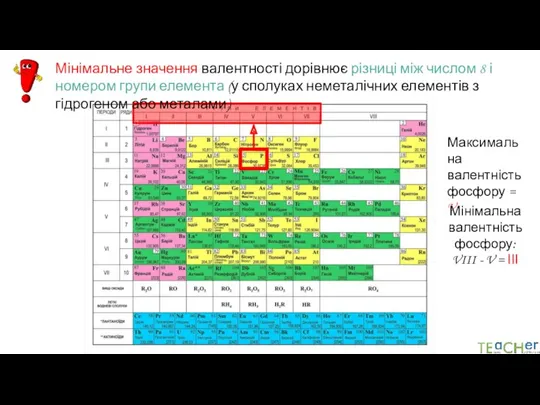
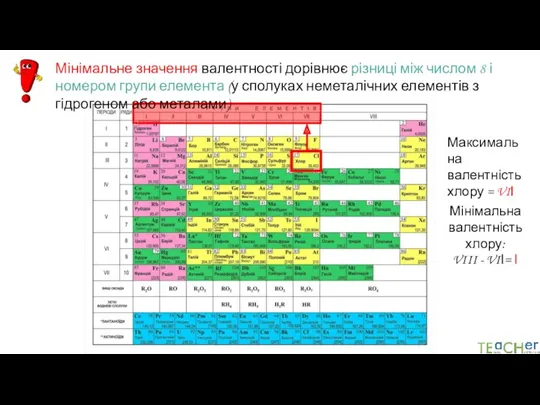
- 12. Максимальне значення валентності елемента дорівнює номеру групи (у сполуках металічних елементів ІА, ІІА, ІІІА груп і
- 13. Мінімальне значення валентності дорівнює різниці між числом 8 і номером групи елемента (у сполуках неметалічних елементів
- 14. Максимальна валентність хлору = VIІ Мінімальна валентність хлору: VIII - VIІ= І Мінімальне значення валентності дорівнює
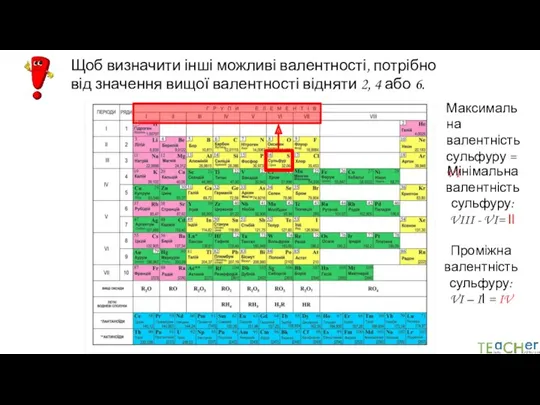
- 15. Щоб визначити інші можливі валентності, потрібно від значення вищої валентності відняти 2, 4 або 6. Максимальна
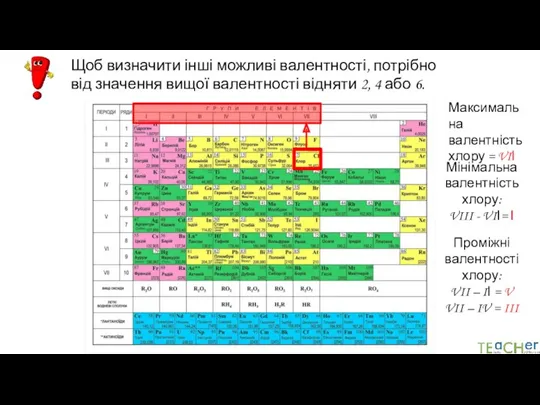
- 16. Щоб визначити інші можливі валентності, потрібно від значення вищої валентності відняти 2, 4 або 6. Максимальна
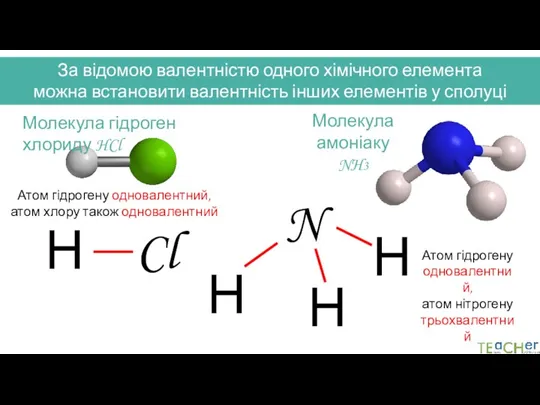
- 17. За відомою валентністю одного хімічного елемента можна встановити валентність інших елементів у сполуці Молекула гідроген хлориду
- 18. Для позначення валентності використовують римські цифри HCl, H2O, NH3, CO2 I I I I II II
- 19. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними Складемо формулу
- 20. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними Аглоритм складання
- 21. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними II VІ
- 22. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними II VІ
- 23. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними II VІ
- 24. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними Аглоритм складання
- 25. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними Аглоритм складання
- 26. Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними Аглоритм складання
- 27. 2 2 Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними
- 28. 2 2 Складання формули бінарної сполуки за валентністю Сполуки, що складаються з двох елементів, називаються бінарними
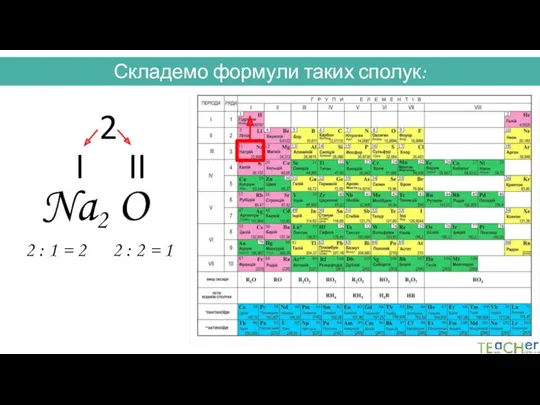
- 29. Складемо формули таких сполук: Na O I II 2 2 : 1 = 2 2 :
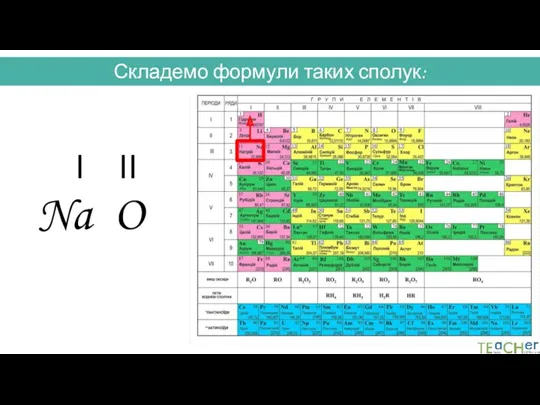
- 30. Складемо формули таких сполук: I II Na O
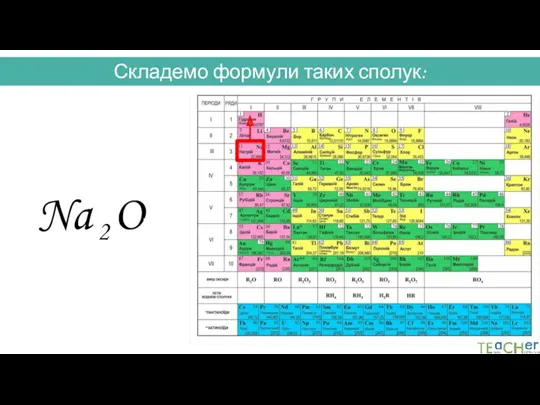
- 31. Складемо формули таких сполук: Na O I II 2
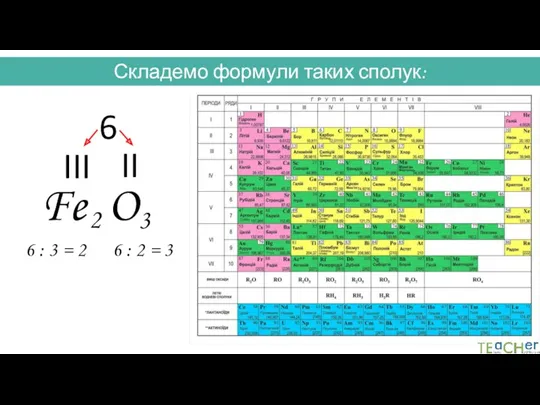
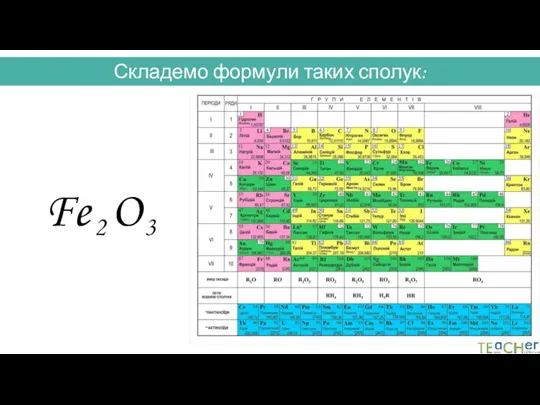
- 32. Складемо формули таких сполук: Fe O III II 6 6 : 3 = 2 6 :
- 33. Складемо формули таких сполук: III II Fe O
- 34. Складемо формули таких сполук: III II 2 3 Fe O
- 35. Складемо формули таких сполук: Ba Cl , C H , C S , Al O II
- 36. Назви бінарних сполук: Назва бінарних сполук складається з двох слів: перше слово – назва першого елемента
- 38. Скачать презентацию


















 Элемент V группы фосфор
Элемент V группы фосфор Первичная переработка нефти
Первичная переработка нефти Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Железо
Железо Основные классы неорганических соединений
Основные классы неорганических соединений Нуклеопротеины
Нуклеопротеины Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Реакции ионного обмена
Реакции ионного обмена Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Алкалоиды, производные тропана
Алкалоиды, производные тропана Титриметрический метод анализа
Титриметрический метод анализа Figure
Figure Урок 25
Урок 25 Лекция 8.3. Реакции окисления и восстановления органических соединений
Лекция 8.3. Реакции окисления и восстановления органических соединений Халькогены. Кислород
Халькогены. Кислород Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Кристаллические решетки
Кристаллические решетки Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химическая связь
Химическая связь Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Методика изучения современной теории строения как фундамента курса органической химии в старшей школе
Методика изучения современной теории строения как фундамента курса органической химии в старшей школе Производные пиримидина
Производные пиримидина Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов