Слайд 2

В результате окисления веществ выделяется энергия, которая запасается в форме высокоэнергетических
соединений, таких как АТФ, а затем расходуется в процессе анаболизма. Реакция окисления способствует детоксикации и выведению ксенобиотиков
Слайд 3

Химические реакции, в процессе которых происходит перенос электронов от одной молекулы
к другой, называются ОВ Окисление - процесс отдачи электронов молекулой, восстановление – приобретение электронов
Слайд 4

Восстановители – доноры электронов
Окислители – акцепторы электронов
Слайд 5

В органической химии под окислением понимают реакции, при которых происходит удаление
из молекулы атомов водорода или образование более полярных связей из менее полярных
Слайд 6
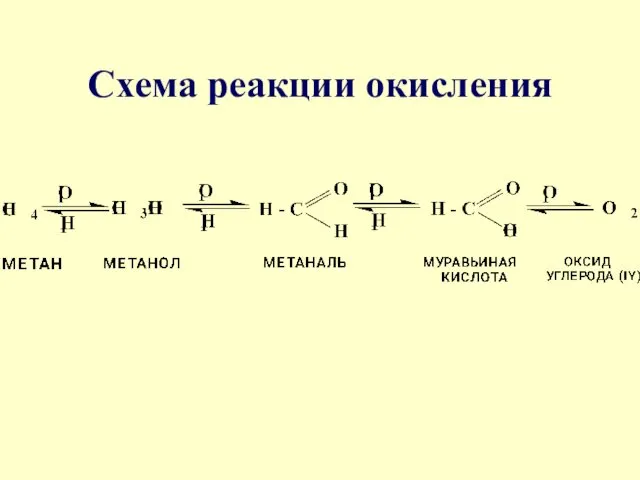
Слайд 7

Механизмы окисления и восстановления
Прямой перенос ē (одноэлектронный перенос)
Fе2+–
ē → Fе3+
Эта ОВ пара может отдавать свои электроны любому восстанавли-вающемуся соединению
Слайд 8

2. Перенос атома водорода (свободнорадикальный разрыв связи R–Н)
3. Перенос
электронов от донора к акцептору в форме гидрид-иона Н –
Слайд 9

4. Перенос электронов путем прямого взаимодействия органического восстановителя с кислородом, приводящий
к продукту с ковалентно-связанным кислородом
Слайд 10

Примером последней реакции может служить алифатическое гидроксилирование – один из путей
биотрансформации лекарственных средств (ЛС) в организме, приводящий к повышению полярности и гидрофильности ЛС, что способствует их выведению из организма
Слайд 11

Взаимодействие ЛС с кислородом происходит в митохондриях
Слайд 12

Примерами реакций окисления и восстановления являются реакции дегидрирования и гидрирования
Слайд 13
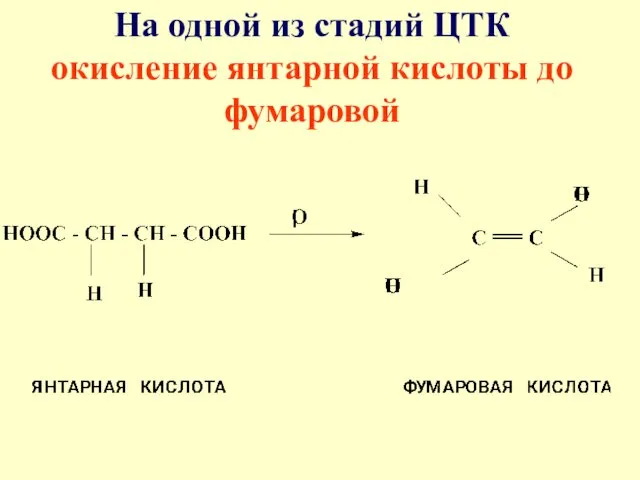
На одной из стадий ЦТК окисление янтарной кислоты до фумаровой
Слайд 14

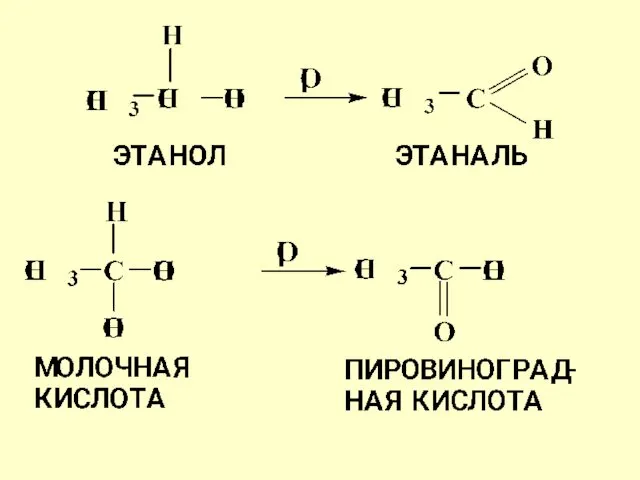
Окисление гидроксильных и оксогрупп
Спирты обладают большей способностью к окислению, чем насыщенные
углеводороды Первичные спирты окисляются до соответствующих альдегидов, вторичные спирты – до кетонов,
Слайд 15
Слайд 16
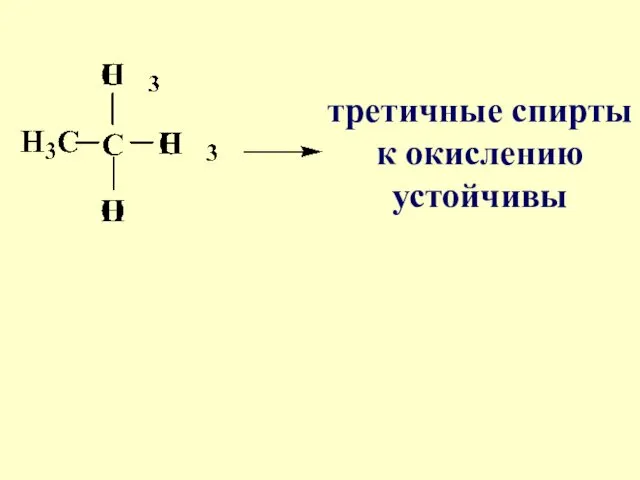
третичные спирты к окислению устойчивы
Слайд 17
![Альдегиды легко окисляются до соответствующих кислот [O]: KMnO4, CrO3, [Ag(NH3)2]OH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/107548/slide-16.jpg)
Альдегиды легко окисляются до соответствующих кислот
[O]: KMnO4, CrO3, [Ag(NH3)2]OH –реактив Толленса,
Cu(OH)2 – реактив Троммера и другие
Слайд 18

Кетоны к окислению устойчивы
Слайд 19
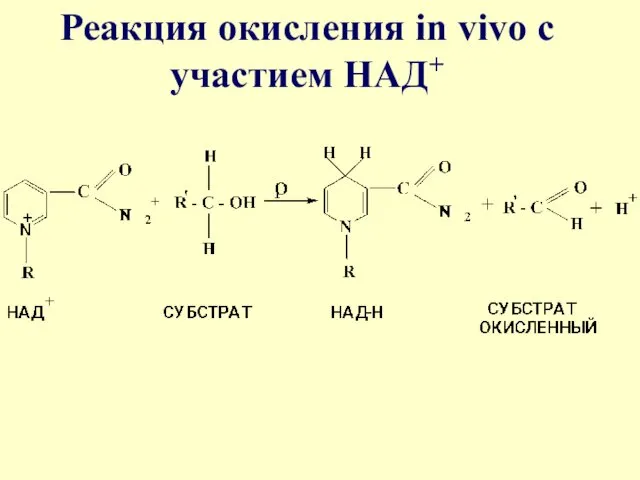
Реакция окисления in vivo с участием НАД+
Слайд 20
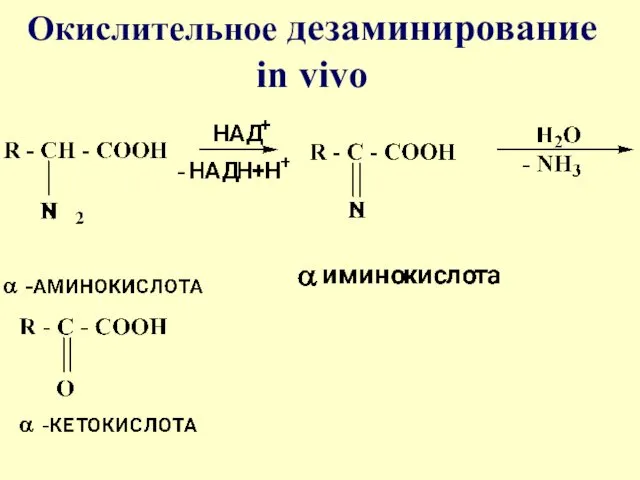
-
Окислительное дезаминирование in vivo
Слайд 21

Реакции восстановления
Реакции восстановления обратны реакциям окисления: восстановление альдегидов приводит к образованию
первичных спиртов; кетонов – вторичных спиртов
Слайд 22

В качестве восстанавливающего агента in vitro используют алюмогидрид лития LiAlH4 или
гидриды щелочных металлов
Слайд 23
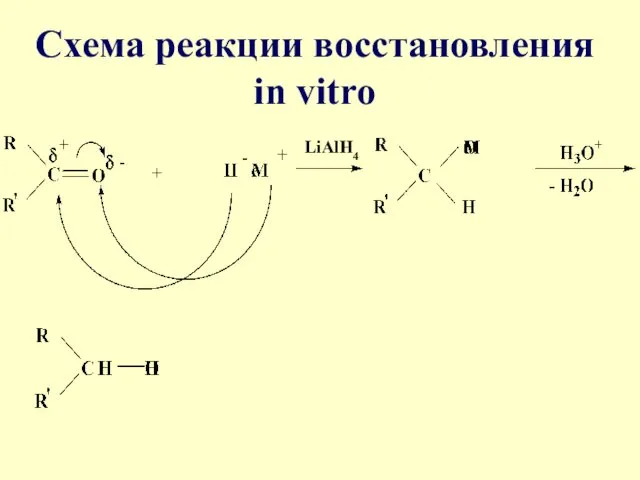
Схема реакции восстановления
in vitro
LiAlH4
Слайд 24

Схема реакции восстановления in vivo
Слайд 25

Обратимые ОВ системы организма
К ним относятся системы – гидрохинон-хинон и сульфид-дисульфид
Легкость перехода из окисленной в восстановленную форму и обратимость таких реакций служат основой для их участия в биологически важных процессах
Слайд 26
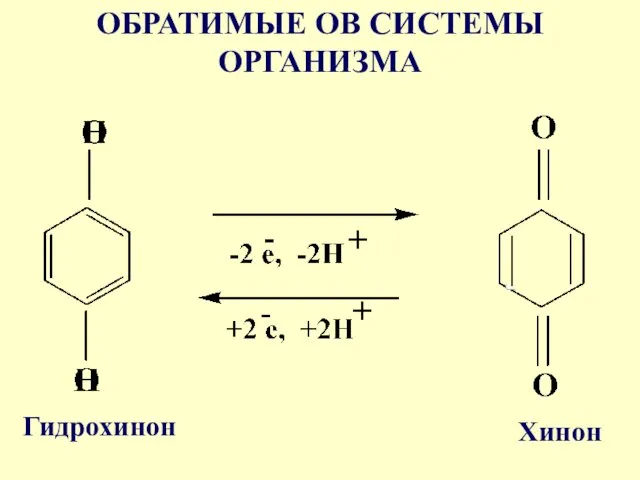
ОБРАТИМЫЕ ОВ СИСТЕМЫ ОРГАНИЗМА
Гидрохинон
Хинон
Слайд 27

Система гидрохинон-хинон входит в состав
кофермента Q-убихинон, участвует в переносе электронов
в митохондриях и дыхательной цепи
Слайд 28

Обратимая ОВ реакция в системе сульфид-дисульфид играет важную роль в
формировании пространственной структуры белков
Слайд 29
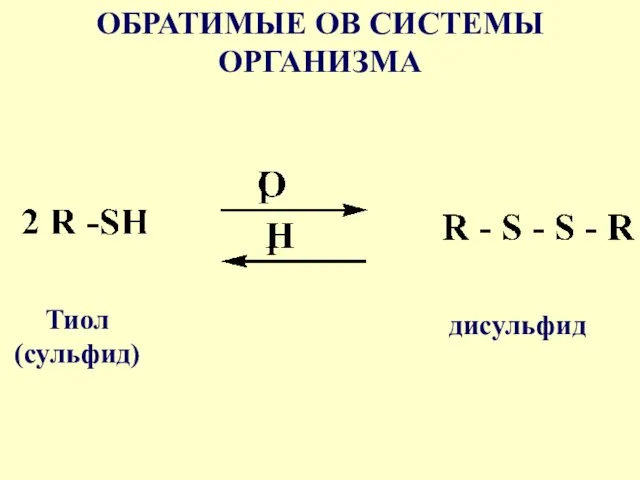
ОБРАТИМЫЕ ОВ СИСТЕМЫ ОРГАНИЗМА
Тиол (сульфид)
дисульфид















![Альдегиды легко окисляются до соответствующих кислот [O]: KMnO4, CrO3, [Ag(NH3)2]OH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/107548/slide-16.jpg)












 Химические свойства алканов
Химические свойства алканов Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Галогены
Галогены Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Стратегия химической промышленности
Стратегия химической промышленности Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Степень окисления
Степень окисления Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Альдегиды и кетоны
Альдегиды и кетоны Кислород и озон
Кислород и озон Типы химических реакций. Опыты
Типы химических реакций. Опыты Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Реакции нейтрализации
Реакции нейтрализации Камень чароит
Камень чароит Теория строения органических веществ А.М. Бутлерова
Теория строения органических веществ А.М. Бутлерова Азотсодержащие органические соединения
Азотсодержащие органические соединения Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Газовые смеси
Газовые смеси Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Теория электролитической диссоциации
Теория электролитической диссоциации Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Химические свойства толуола
Химические свойства толуола Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Химиялық элемент алюминий
Химиялық элемент алюминий