Содержание
- 2. Химическая активность Все алканы характеризуются низкой химической активностью. Они не взаимодействуют с растворами кислот, оснований, солей.
- 3. Галогенирование. Взаимодействие с галогенами Галогенирование - реакция замещения одного или нескольких атомов водорода в молекуле алкана
- 4. Пиролиз Разложение веществ при высоких температурах называют пиролизом. Пиролиз происходит только при высоких температурах. СН4 ––>
- 5. Изомеризация Процесс превращения одного изомера в другой называется изомеризация. Это свойство возможно для алканов, начиная с
- 6. Горение. Взаимодействие с кислородом Важнейшее свойство алканов - горение. Горение - реакция взаимодействия алканов с кислородом.
- 8. Скачать презентацию





 Рождение органической химии
Рождение органической химии Химические свойства металлов
Химические свойства металлов Чистые вещества и смеси
Чистые вещества и смеси Осмий. Нахождение в природе
Осмий. Нахождение в природе Корбонаттар көмір қышқылынның тұздары
Корбонаттар көмір қышқылынның тұздары Соли. Свойства солей
Соли. Свойства солей Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Бутадиеновые каучуки
Бутадиеновые каучуки Алюминий
Алюминий Phosphorus
Phosphorus Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Получение и применение спиртов
Получение и применение спиртов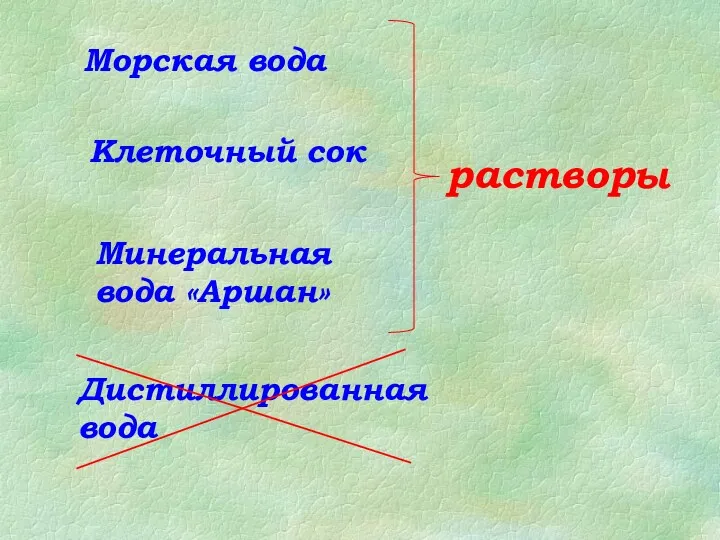 Растворы и растворители
Растворы и растворители Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей ВОДОРОД
ВОДОРОД Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5
Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5 Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Хлор
Хлор Аминокислоты и белки
Аминокислоты и белки Строение атома
Строение атома Химия в повседневной жизни человека
Химия в повседневной жизни человека Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Обмен липидов
Обмен липидов Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Нефть и способы её переработки
Нефть и способы её переработки