Содержание
- 2. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
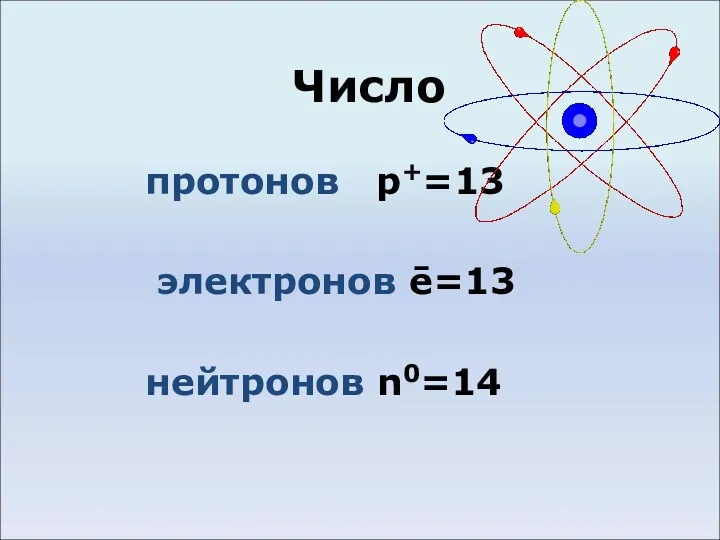
- 3. Число протонов p+=13 электронов ē=13 нейтронов n0=14
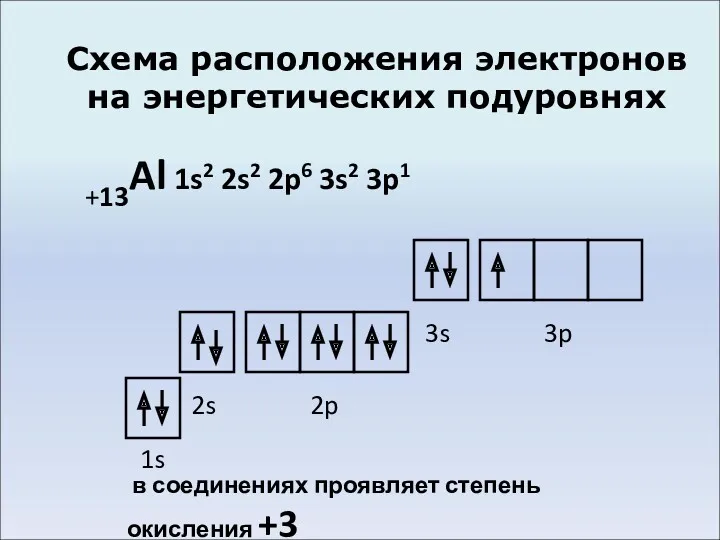
- 4. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 5. Al – типичный металл Восстановительные свойства Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической
- 6. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 7. Особенности физических и химических свойств алюминия, его нахождения в природе и применения: Алюминий – самый распространенный
- 8. Алюминий реагирует с простыми веществами - неметаллами 4Al+3O2 = 2Al2O3 Поверхность покрывается пленкой оксида, в мелкораздробленном
- 9. Алюминий реагирует со сложными веществами: Алюминий растворяется в растворах кислот 2Al + 6HCl = 2AlCl3 +
- 10. Алюминий реагирует со сложными веществами: 3. Алюминий при высокой температуре реагирует с оксидами менее активных металлов
- 11. Алюминий реагирует со сложными веществами: 4.Так как алюминий – амфотерный металл, он реагирует с растворами щелочей.
- 12. Получение алюминия Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 13. Применение Al
- 14. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре
- 15. Оксид алюминия Al2О3: Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета, тугоплавкий - 20500С. Не
- 16. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 18. Скачать презентацию












 Хімічні формули речовин
Хімічні формули речовин Водород
Водород Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Материаловедение промышленного производства. Особенности строения твердых тел
Материаловедение промышленного производства. Особенности строения твердых тел Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Современные химические технологии
Современные химические технологии Каталитический риформинг
Каталитический риформинг Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Простые вещества
Простые вещества Незвичайна вода
Незвичайна вода Фазовое равновесие
Фазовое равновесие Химия в повседневной жизни человека
Химия в повседневной жизни человека Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи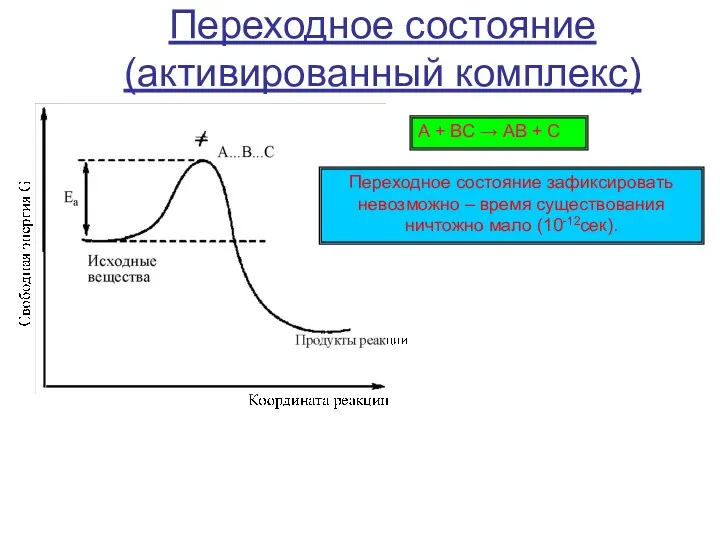 Химические свойства карбокатионов
Химические свойства карбокатионов Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Скорость химических реакций
Скорость химических реакций