Содержание
- 2. Цели урока Вспомнить понятие о кислотах, как о классе электролитов; Рассмотреть классификацию кислот по различным признакам;
- 3. План урока I. Состав и классификация кислот; II. Ионные уравнения реакций на примере химических свойств кислот;
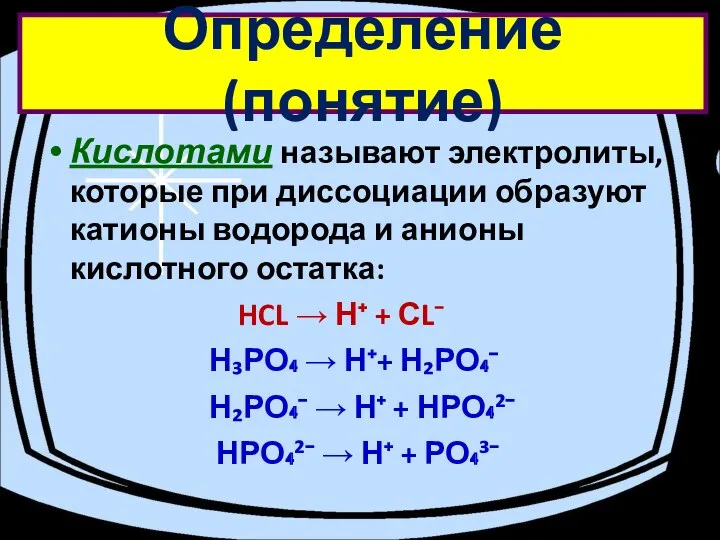
- 4. Определение (понятие) Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка: HCL
- 5. Задание Выберите формулы кислот: КNО₂ Н₂О₂ Н₂СО₃ NаНSО₄ NаОН НF Са(ОН)₂ Мg(НСО₃)₂ Н₂SО₄ Аl(NО₃)₃ СuОН Н₂МnО₂
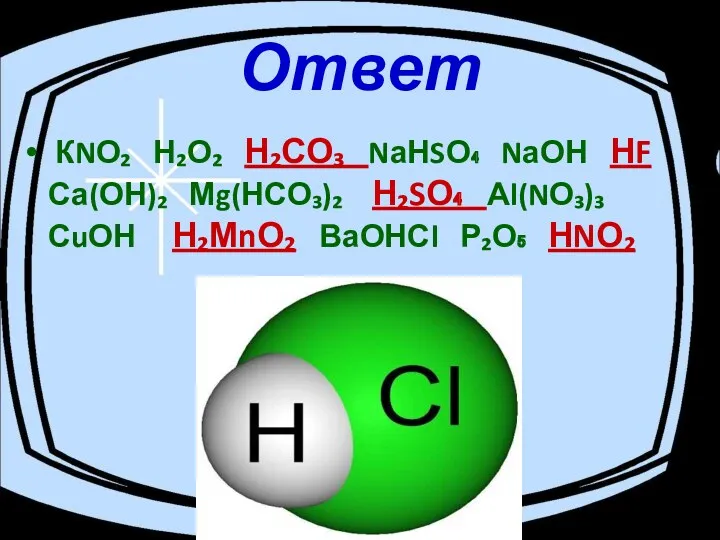
- 6. Ответ КNО₂ Н₂О₂ Н₂СО₃ NаНSО₄ NаОН НF Са(ОН)₂ Мg(НСО₃)₂ Н₂SО₄ Аl(NО₃)₃ СuОН Н₂МnО₂ ВаОНСl Р₂О₅ НNО₂
- 7. Задание № 1 I вариант 1)Используя содержание таблицы, дайте характеристику соляной (хлороводородной) кислоты угольной кислоты .
- 8. Ответ (НСl) Бескислородная; Одноосновная; Растворимая; Летучая; Сильная; Стабильная; (Н₂CО₃) Кислородная; Двухосновная; Растворимая; Летучая; Слабая; Нестабильная;
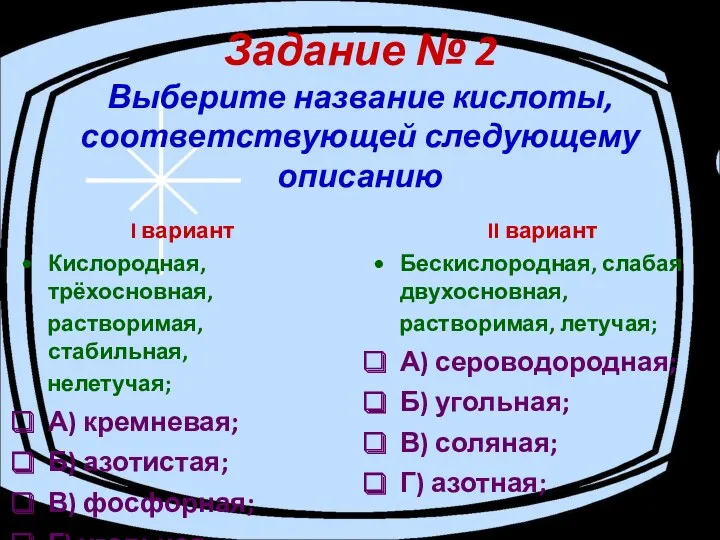
- 9. Задание № 2 Выберите название кислоты, соответствующей следующему описанию I вариант Кислородная, трёхосновная, растворимая, стабильная, нелетучая;
- 10. Задание № 3 Установите соответствие между названием кислоты и её признаками А) сероводородная; Б) серная; В)
- 11. Ответ Задание № 1 – В (фосфорная); Задание № 2 – Г1; Б2; Задание № 1
- 12. Химические свойства кислот 1)Реакция нейтрализации: кислота + основание → соль + вода (реакция обмена)
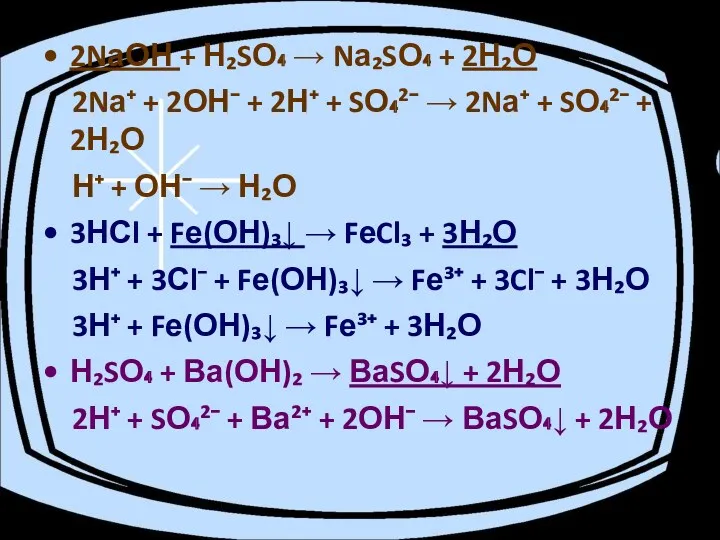
- 13. 2NаОН + Н₂SО₄ → Nа₂SО₄ + 2Н₂О 2Nа⁺ + 2ОН⁻ + 2Н⁺ + SО₄²⁻ → 2Nа⁺
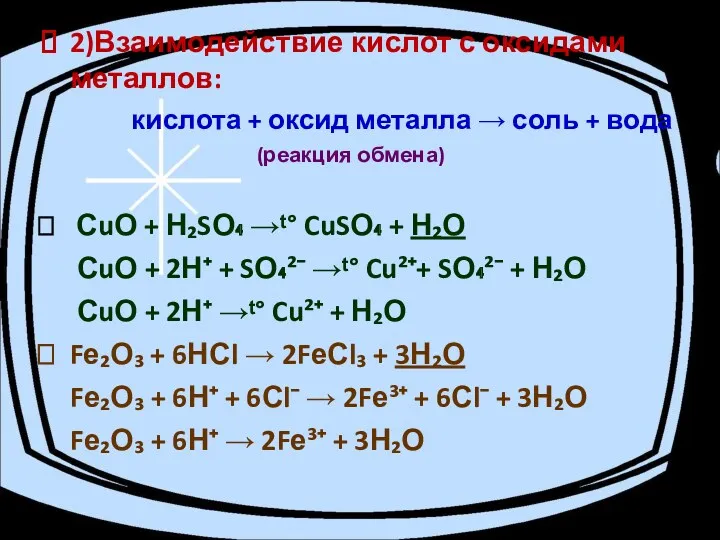
- 14. 2)Взаимодействие кислот с оксидами металлов: кислота + оксид металла → соль + вода (реакция обмена) СuО
- 15. 3)Взаимодействие кислот с металлами: кислота + металл → соль + водород (реакция замещения) Условия протекания реакций:
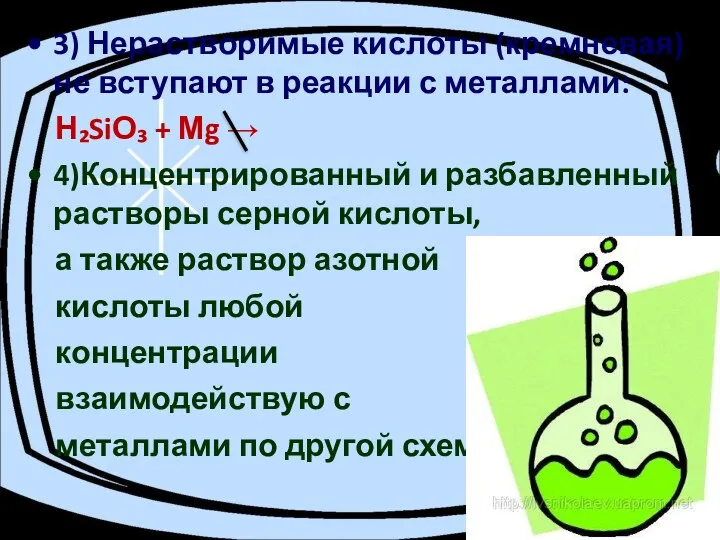
- 16. 3) Нерастворимые кислоты (кремневая) не вступают в реакции с металлами: Н₂SiО₃ + Мg → 4)Концентрированный и
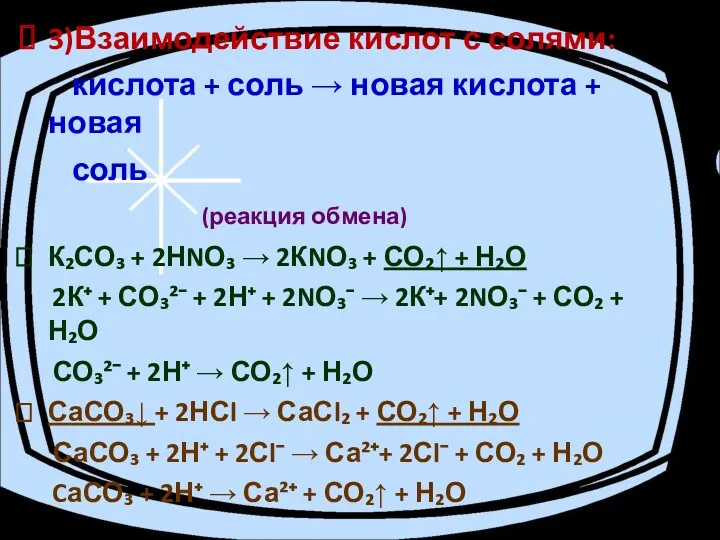
- 17. 3)Взаимодействие кислот с солями: кислота + соль → новая кислота + новая соль (реакция обмена) К₂СО₃
- 18. Качественная реакция на SО₄²⁻ (сульфат-ион) ВаСl₂ + Н₂SО₄ → ВаSО₄↓ + 2НСl Ва²⁺ + 2Сl⁻ +
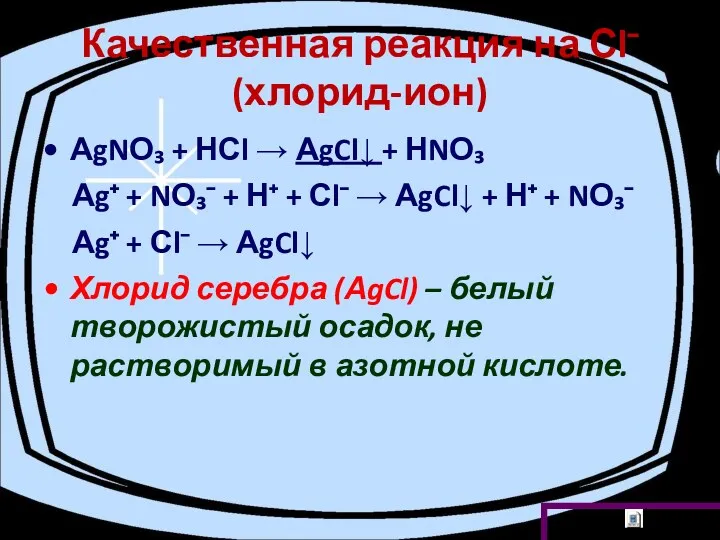
- 19. Качественная реакция на Сl⁻ (хлорид-ион) АgNО₃ + НСl → АgCl↓ + НNО₃ Аg⁺ + NО₃⁻ +
- 20. Итоги 1. Классификация кислот; 2. Типичные химические свойства кислот; 3. Условия протекания типичных реакций кислот;
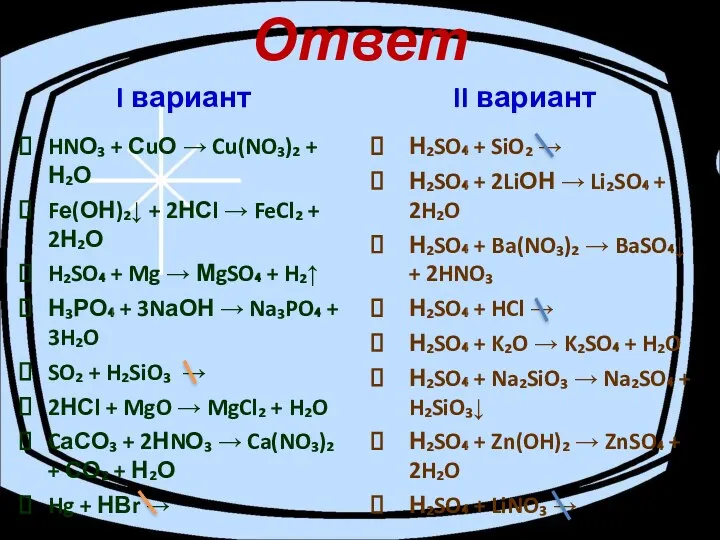
- 21. Допишите уравнения реакций, отражающие химические свойства кислот: HNО₃ + СuО → Fе(ОН)₂ + НСl → H₂SO₄
- 22. Ответ I вариант HNО₃ + СuО → Cu(NO₃)₂ + Н₂О Fе(ОН)₂↓ + 2НСl → FeCl₂ +
- 24. Скачать презентацию










 Щелочные металлы
Щелочные металлы Organic Compounds
Organic Compounds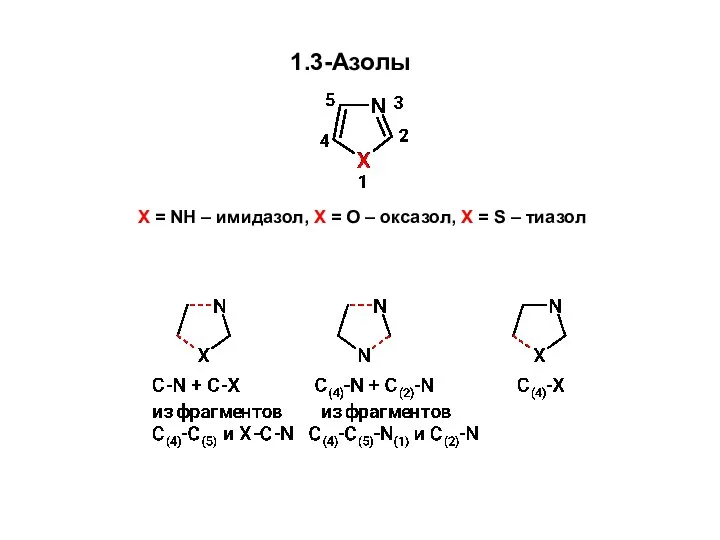 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Алкоголь
Алкоголь Алюминий и его свойства
Алюминий и его свойства Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Молибден. Нахождение в природе
Молибден. Нахождение в природе Способы выражения состава растворов
Способы выражения состава растворов Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас Кристаллическая решетка
Кристаллическая решетка Каменный уголь и методы его переработки
Каменный уголь и методы его переработки Геохимия. Проблемы геохимии. Геохимические методы
Геохимия. Проблемы геохимии. Геохимические методы Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические реакции. Классификация химических реакций
Химические реакции. Классификация химических реакций Калийные удобрения
Калийные удобрения Введение в органическую химию
Введение в органическую химию Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Свойства минералов Лекция 3
Свойства минералов Лекция 3 Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Материаловедение. Лекция 1
Материаловедение. Лекция 1 Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Механическая смесь и растворы
Механическая смесь и растворы