Содержание
- 2. Содержание дисциплины «Материаловедение» МОДУЛЬ 1. ОСНОВЫ СТРОЕНИЯ И СВОЙСТВ МАТЕРИАЛОВ МОДУЛЬ 2. СПЛАВЫ НА ОСНОВЕ ЖЕЛЕЗА
- 3. СПИСОК ЛИТЕРАТУРЫ 1. Гуляев, А.П. Металловедение: учебник для вузов / А.П. Гуляев. – М.: Металлургия, 1986.
- 4. МОДУЛЬ 1 ОСНОВЫ СТРОЕНИЯ И СВОЙСТВ МАТЕРИАЛОВ
- 5. ТЕМА 1. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ. КРИСТАЛЛИЗАЦИЯ Металловедение – наука, изучающая строение и свойства металлов, и устанавливающая
- 6. Черные металлы имеют темно-серый цвет, большую плотность (кроме щелочноземельных) высокую температуру плавления, относительно высокую твердость и
- 7. Черные металлы подразделяются: 1. Железные металлы – Fe, Co, Ni, Mn. 2. Тугоплавкие металлы – Mo,
- 8. Цветные металлы подразделяются : 1.Легкие металлы - Be, Mg, Al, обладающие малой плотностью. 2. Благородные металлы
- 9. Кристаллическое строение можно представить себе в виде пространственной кристаллической решетки, в узлах которой расположены атомы. Расположение
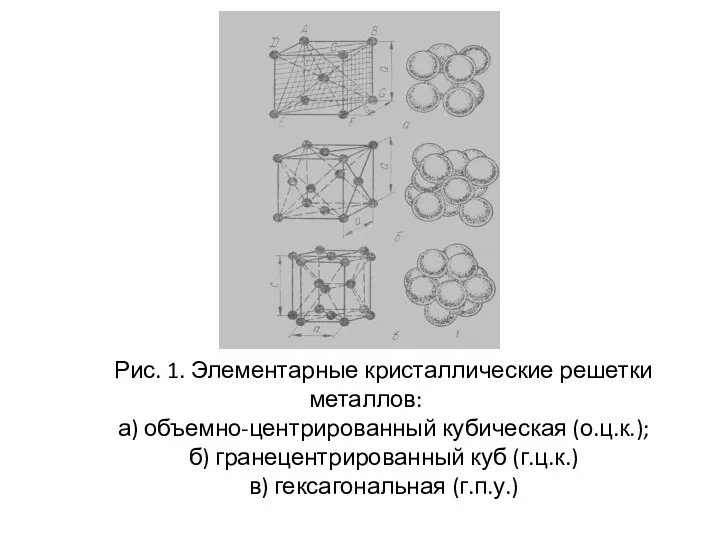
- 10. Рис. 1. Элементарные кристаллические решетки металлов: а) объемно-центрированный кубическая (о.ц.к.); б) гранецентрированный куб (г.ц.к.) в) гексагональная
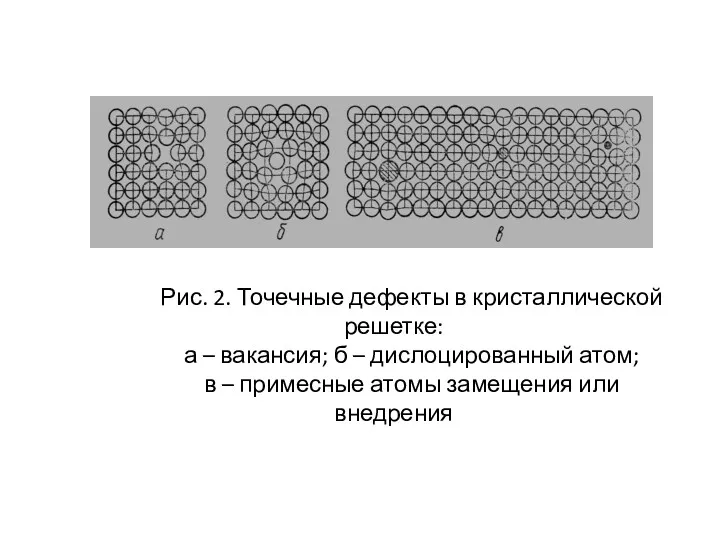
- 11. Рис. 2. Точечные дефекты в кристаллической решетке: а – вакансия; б – дислоцированный атом; в –
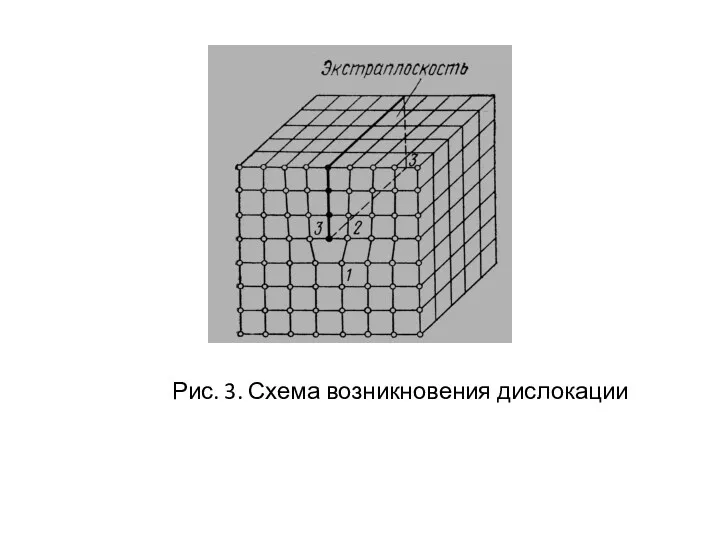
- 12. Рис. 3. Схема возникновения дислокации
- 13. Анизотропия – это неодинаковость свойств монокристаллов в разных кристаллографических направлениях
- 14. При переходе из жидкого состояния в твердое образуется кристаллическая решетка, возникают кристаллы. Такой процесс называется кристаллизацией.
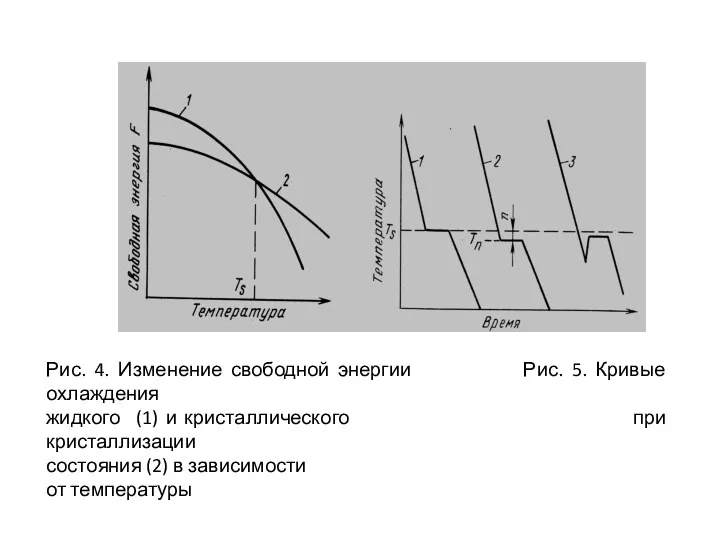
- 16. Рис. 4. Изменение свободной энергии Рис. 5. Кривые охлаждения жидкого (1) и кристаллического при кристаллизации состояния
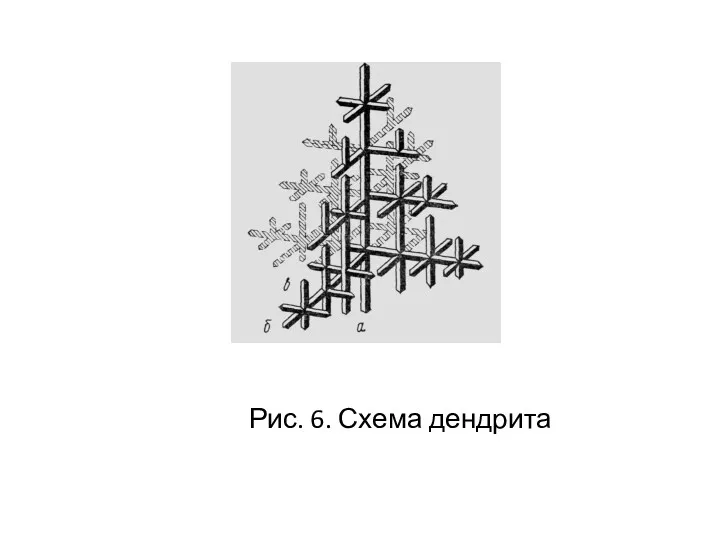
- 17. Рис. 6. Схема дендрита
- 18. Рис. 7. Схема стального слитка
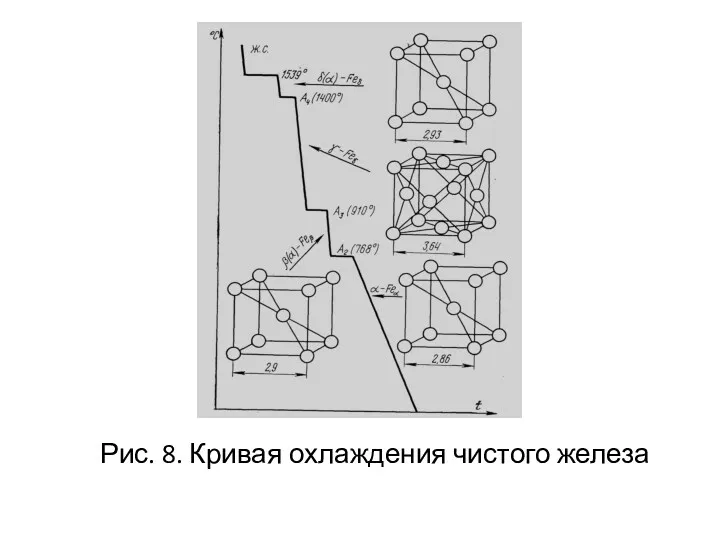
- 19. Полиморфизм или аллотропия - это существование одного металла (вещества) в нескольких кристаллических формах.
- 20. Рис. 8. Кривая охлаждения чистого железа
- 21. ТЕМА 2. СВОЙСТВА МЕТАЛЛОВ И СПЛАВОВ
- 22. Металлы и сплавы характеризуются механическими, физическими, химическими и технологическими свойствами. Они определяют соответствие выбранного материала расчетным
- 23. Внешняя нагрузка вызывает в твердом теле напряжение и деформацию. Напряжение – это нагрузка Р (Н), отнесенная
- 24. Напряжение, отвечающее наибольшей нагрузке, предшествующей разрушению образца, называется пределом прочности при растяжении: σв = Рв /
- 25. Пластичность – способность металла получать остаточную деформацию без разрушения. Характеризуют пластичность относительным удлинением δ и относительным
- 26. Твердость – способность материала сопротивляться пластической деформации при контактном воздействии в поверхностном слое. Наибольшее применение получили
- 27. ТЕМА 3. ТЕОРИЯ СПЛАВОВ Сплавами называются вещества, состоящие из двух и более элементов (компонентов).
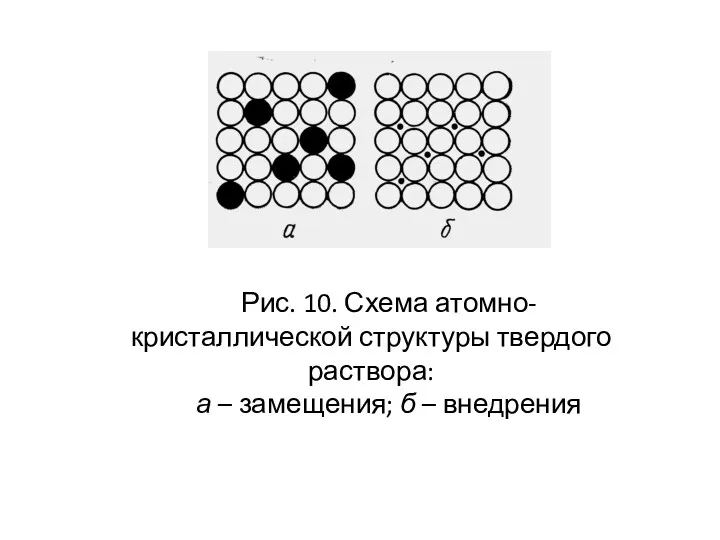
- 28. В жидком состоянии элементы (компоненты) сплава в большинстве случаев обладают неограниченной взаимной растворимостью. После затвердевания компоненты,
- 29. Рис. 10. Схема атомно-кристаллической структуры твердого раствора: а – замещения; б – внедрения
- 30. Правило фаз (правило Гиббса) устанавливает числовую зависимость между фазами, компонентами и степенью свободы системы.
- 31. Системой называются металлы и металлические сплавы, выбранные для наблюдения и изучения при определенных условиях (температура, давление).
- 32. Числом степеней свободы (С) системы называют число внешних и внутренних факторов (температура, концентрация, давление), которое можно
- 33. Диаграмма состояния – это график, на котором отражена зависимость между фазовым составом, температурой и концентрацией сплава.
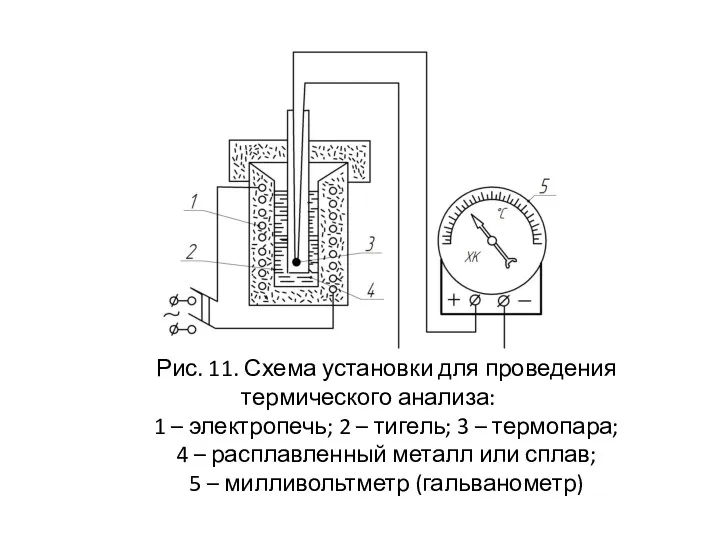
- 34. Диаграммы состояния строят с помощью термического анализа. Он основан на получении серии кривых охлаждения жидкого сплава
- 35. Рис. 11. Схема установки для проведения термического анализа: 1 – электропечь; 2 – тигель; 3 –
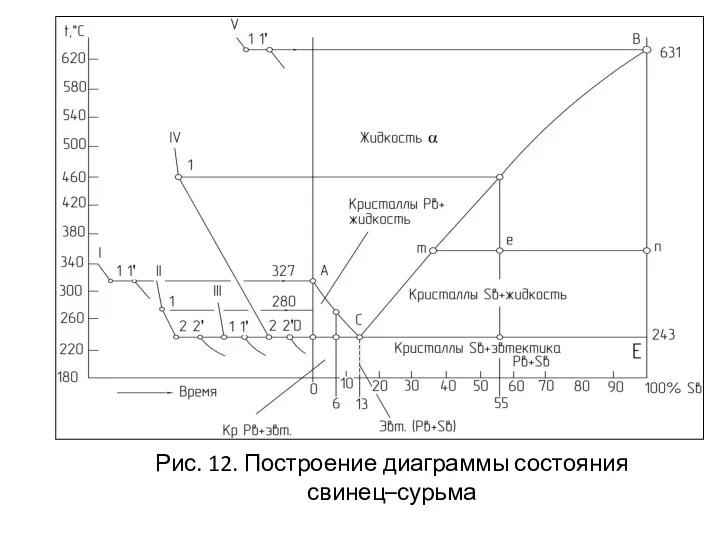
- 36. ДИАГРАММА СОСТОЯНИЯ ДЛЯ СПЛАВОВ, ОБРАЗУЮЩИХ МЕХАНИЧЕСКИЕ СМЕСИ ИЗ ЧИСТЫХ КОМПОНЕНТОВ (ПЕРВОГО РОДА) Оба компонента в жидком
- 37. Рис. 12. Построение диаграммы состояния свинец–сурьма
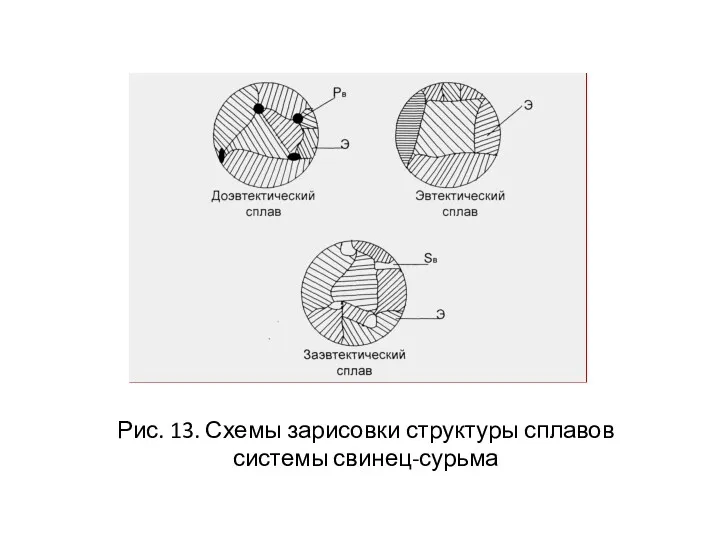
- 38. Рис. 13. Схемы зарисовки структуры сплавов системы свинец-сурьма
- 39. ПРАВИЛО ОПРЕДЕЛЕНИЯ СОСТАВА ФАЗ (ПРАВИЛО КОНЦЕНТРАЦИЙ) Чтобы определить концентрацию компонентов в фазах, через данную точку, характеризующую
- 40. ПРАВИЛО КОЛИЧЕСТВЕННОГО СООТНОШЕНИЯ ФАЗ (ПРАВИЛОМ КОНОДЫ): Для того, чтобы определить количественное соотношение фаз, через заданную точку
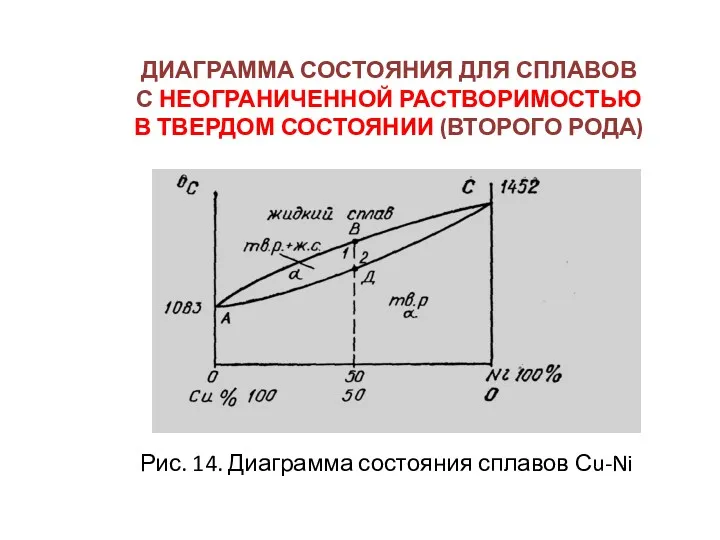
- 41. ДИАГРАММА СОСТОЯНИЯ ДЛЯ СПЛАВОВ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ В ТВЕРДОМ СОСТОЯНИИ (ВТОРОГО РОДА) Рис. 14. Диаграмма состояния
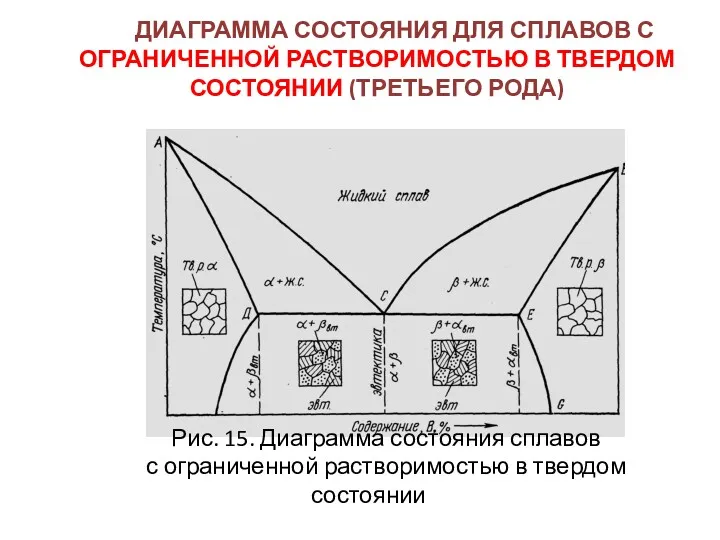
- 42. ДИАГРАММА СОСТОЯНИЯ ДЛЯ СПЛАВОВ С ОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ В ТВЕРДОМ СОСТОЯНИИ (ТРЕТЬЕГО РОДА) Рис. 15. Диаграмма состояния
- 44. Скачать презентацию




























 Метрологические основы аналитической химии
Метрологические основы аналитической химии Растворы. Термодинамика образования растворов. Растворимость веществ (Лекция 3)
Растворы. Термодинамика образования растворов. Растворимость веществ (Лекция 3) Фенолы
Фенолы Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Переходные элементы
Переходные элементы Степень окисления
Степень окисления Химическая промышленность России
Химическая промышленность России Товары бытовой химии
Товары бытовой химии Хімічні явища в побуті
Хімічні явища в побуті ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Строение атома и атомного ядра. Периодическая система химических элементов. (Часть 2)
Строение атома и атомного ядра. Периодическая система химических элементов. (Часть 2) Технология переработки нефти. Синтез метил-трет-бутилового и трет-амилметилового эфиров. (Лекция 4.4)
Технология переработки нефти. Синтез метил-трет-бутилового и трет-амилметилового эфиров. (Лекция 4.4) Положение металлов в Периодической системе
Положение металлов в Периодической системе Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Получение и приминение этилена
Получение и приминение этилена Каталитический риформинг
Каталитический риформинг Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Химическая кинетика и катализ
Химическая кинетика и катализ Строение атома и периодический закон Д.И. Менделеева
Строение атома и периодический закон Д.И. Менделеева Важнейшие классы бинарных соединений
Важнейшие классы бинарных соединений Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Синтез на основі бензену
Синтез на основі бензену Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Общая теория протолитических равновесий и процессов. Буферные системы
Общая теория протолитических равновесий и процессов. Буферные системы