Содержание
- 2. 92 металла
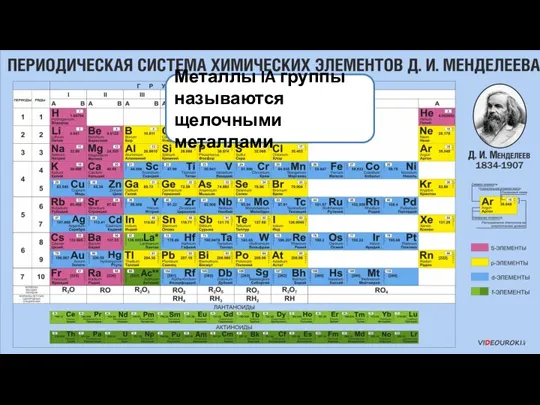
- 3. Металлы IA группы называются щелочными металлами
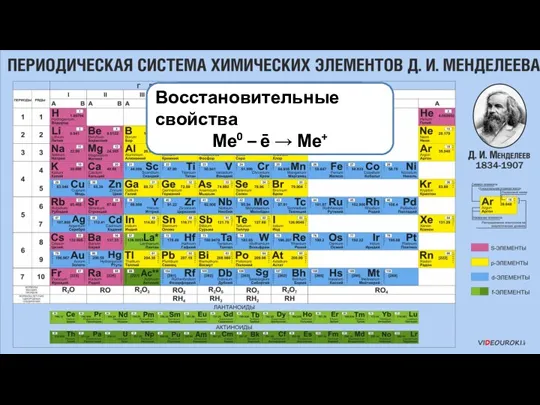
- 4. Гидроксиды щелочных металлов – щёлочи Имеют один электрон на внешнем уровне Восстановительные свойства Ме0 – ē
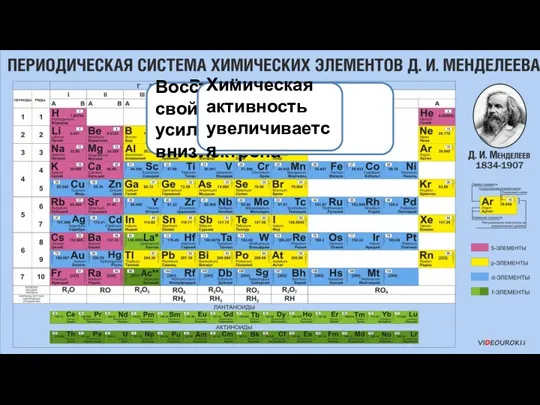
- 5. Увеличиваются радиусы атомов Растёт способность к отдаче внешнего электрона Восстановительные свойства усиливаются сверху вниз Химическая активность
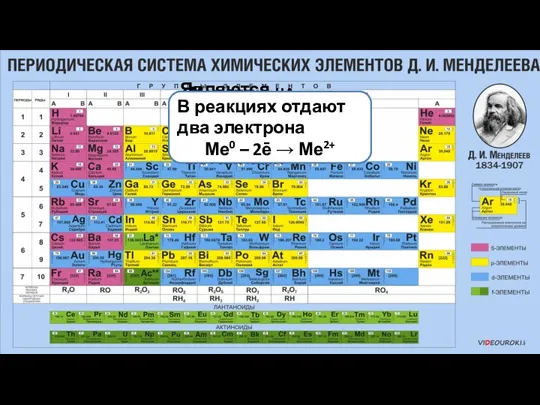
- 6. Металлы IIA группы являются типичными металлами Являются сильными восстановителями В реакциях отдают два электрона Ме0 –
- 7. Щелочноземельные элементы
- 8. Ме0 – 3ē → Ме3+ На внешнем уровне 3 электрона
- 9. Элементы побочных подгрупп все являются металлами На внешнем уровне 1-2 электрона, остальные – на предвнешнем
- 10. ЗАПОМНИТЕ! У металлов сравнительно большие радиусы атомов Их внешние электроны значительно удалены от ядра и слабо
- 11. ЗАПОМНИТЕ Они являются восстановителями Металлы не могут присоединять электроны Они легко отдают электроны, превращаясь при этом
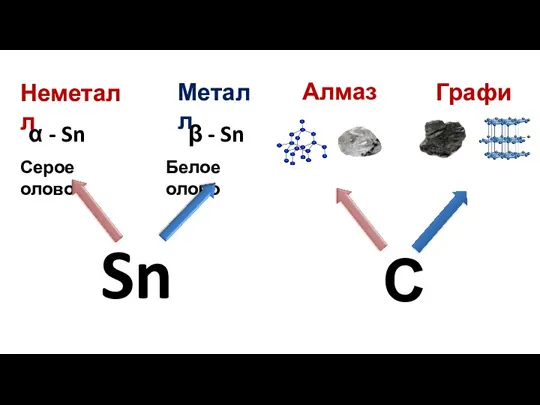
- 12. Деление элементов на металлы и неметаллы условно
- 13. Sn β - Sn α - Sn С Графит Алмаз Серое олово Белое олово Неметалл Металл
- 14. Zn, Cr, Al и другие – типичные металлы Образуют оксиды и гидроксиды амфотерного характера Te, I
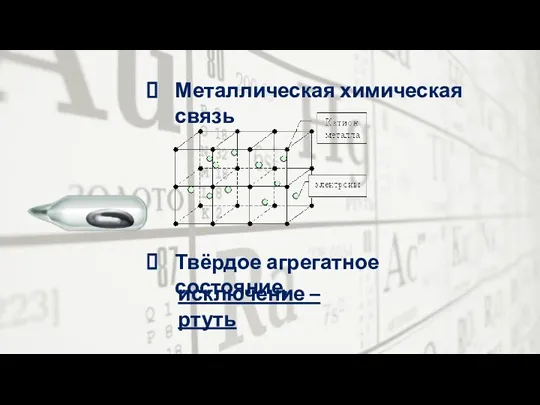
- 15. Металлическая химическая связь Твёрдое агрегатное состояние, исключение – ртуть
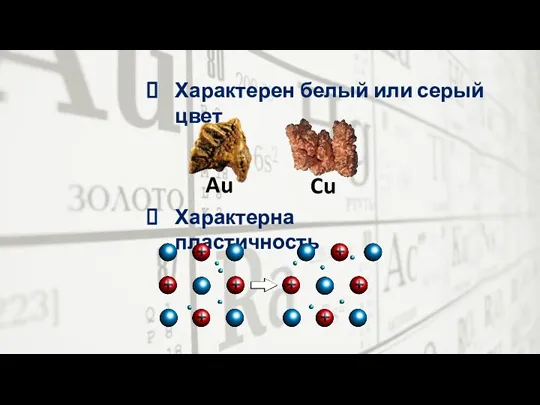
- 16. Характерен белый или серый цвет Характерна пластичность Au Cu
- 18. Характерен белый или серый цвет Характерна пластичность Au Cu
- 19. Наиболее пластичные металлы: Au Ag Cu
- 20. Характерна электропроводность При нагревании снижается электрическая проводимость металлов. При охлаждении, электропроводность металлов усиливается, и близи абсолютного
- 21. Наиболее электропроводны: Ag, Cu Наименее электропроводны: Mn, Pb, Hg, W
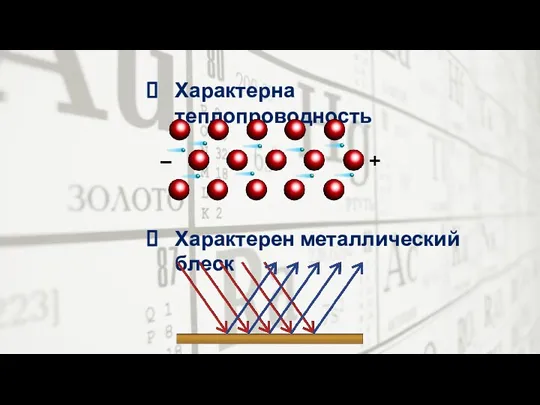
- 22. Характерна теплопроводность Характерен металлический блеск
- 23. Лучше всего отражают свет: Pd Hg Ag Cu
- 24. Из алюминия, серебра и палладия изготавливают зеркала
- 25. Самые твёрдые металлы – это металлы Хром Титан Молибден побочной подгруппы VIA группы
- 26. Самые мягкие – щелочные металлы Натрий
- 27. По плотности Лёгкие (плотность Тяжёлые (плотность > 5 г/см3 ) Лёгкие металлы: щелочные и щелочноземельные металлы,
- 28. По плотности Лёгкие (плотность Тяжёлые (плотность > 5 г/см3 ) Самый тяжёлый металл – осмий, а
- 29. Самый легкоплавкий металл – ртуть, а самый тугоплавкий – вольфрам. Ртуть Вольфрам По температуре плавления Легкоплавкие
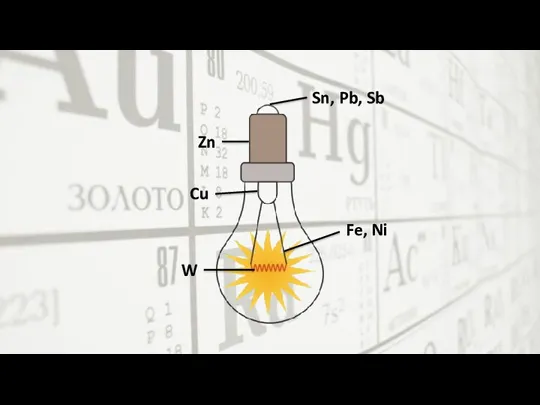
- 30. Sn, Pb, Sb Zn Cu W Fe, Ni
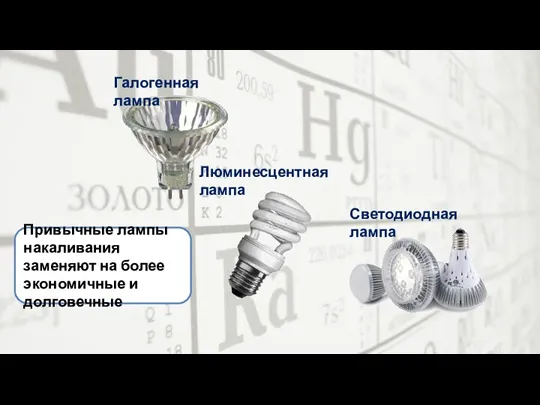
- 31. Галогенная лампа Люминесцентная лампа Светодиодная лампа Привычные лампы накаливания заменяют на более экономичные и долговечные
- 32. Чёрные металлы – это железо и его сплавы
- 33. Цветные – это все остальные металлы
- 34. Золото, серебро, платина и некоторые другие металлы относятся к драгоценным
- 36. Скачать презентацию



















 Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Изотопы химических элементов
Изотопы химических элементов Көмірсулар Қайталау сабағы
Көмірсулар Қайталау сабағы Железо. Положение в ПСХЭ. Строение атома. 9 класс
Железо. Положение в ПСХЭ. Строение атома. 9 класс Метод МО
Метод МО Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Лекция 6. Электрофильное присоединение к кратным связям
Лекция 6. Электрофильное присоединение к кратным связям Жидкие кристаллы
Жидкие кристаллы Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Гидролиз солей
Гидролиз солей Химическое кафе Кислоты
Химическое кафе Кислоты Моющие средства
Моющие средства Кремний және оның қосылыстары
Кремний және оның қосылыстары Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання АЛЮМИНИЙ
АЛЮМИНИЙ Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Бытовая химическая грамотность
Бытовая химическая грамотность Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Гравиметрический метод анализа
Гравиметрический метод анализа Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Кислородные соединения азота
Кислородные соединения азота Структура нуклеїнових кислот
Структура нуклеїнових кислот Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2
Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2 Cкорость химической реакции
Cкорость химической реакции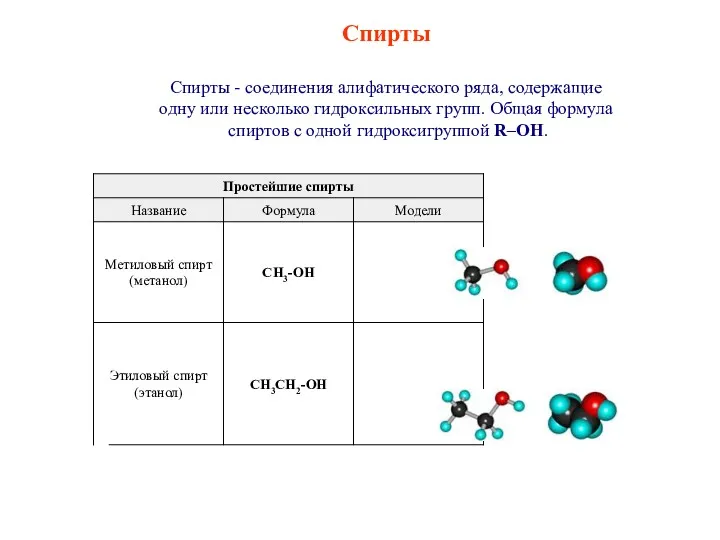 Спирты. Классификация спиртов
Спирты. Классификация спиртов