Содержание
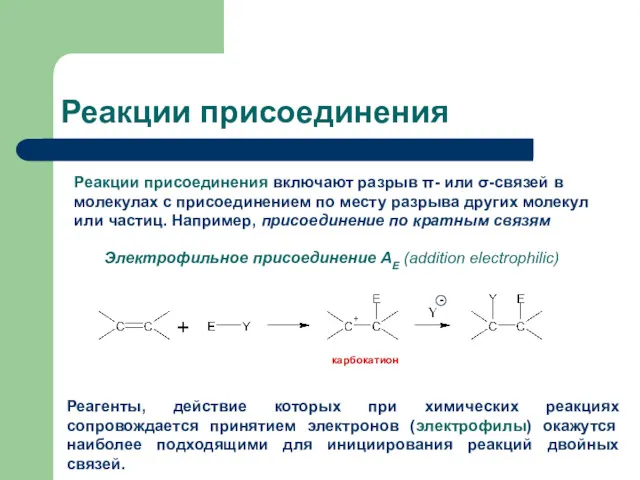
- 2. Реакции присоединения Реакции присоединения включают разрыв π- или σ-связей в молекулах с присоединением по месту разрыва
- 3. Электрофилы Электрофильные реагенты (Е, Е+) – это частицы, образующие новые ковалентные связи за счет пары электронов
- 4. π-связь Двойная углерод-углеродная π-связь является донором электронов
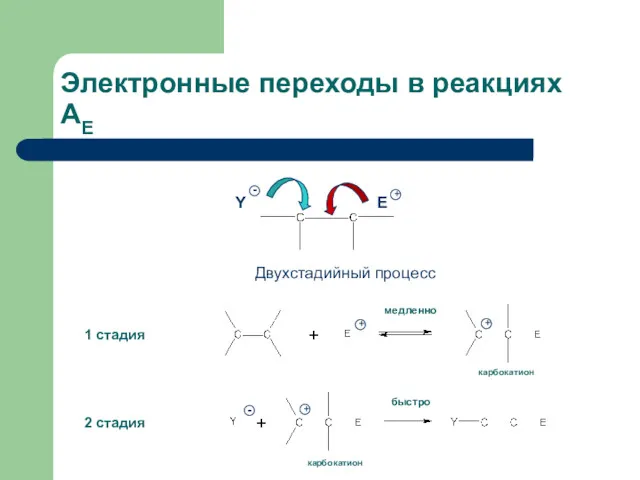
- 5. Электронные переходы в реакциях АЕ 1 стадия 2 стадия карбокатион карбокатион Y Двухстадийный процесс медленно быстро
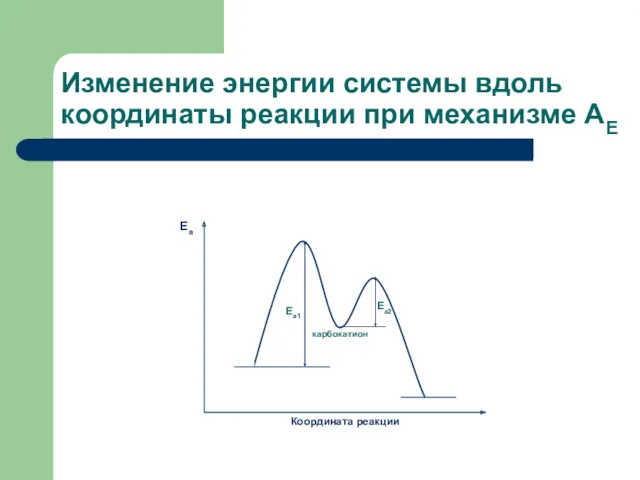
- 6. Изменение энергии системы вдоль координаты реакции при механизме АЕ
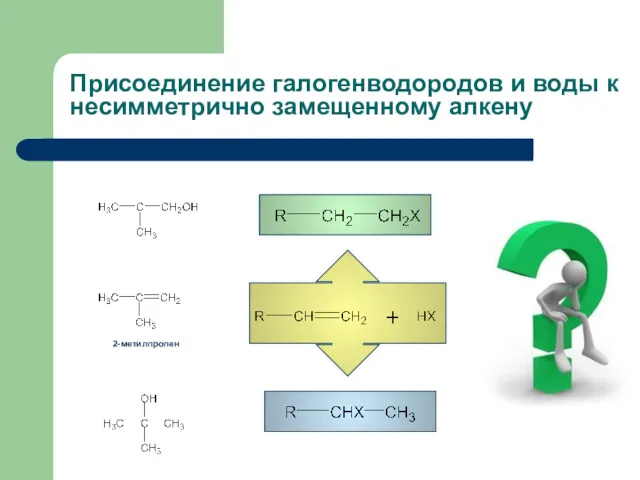
- 7. Присоединение галогенводородов и воды к несимметрично замещенному алкену
- 8. Правило Марковникова В реакциях электрофильного присоединения по двойной связи водород присоединяется к наиболее гидрированному атому углерода:
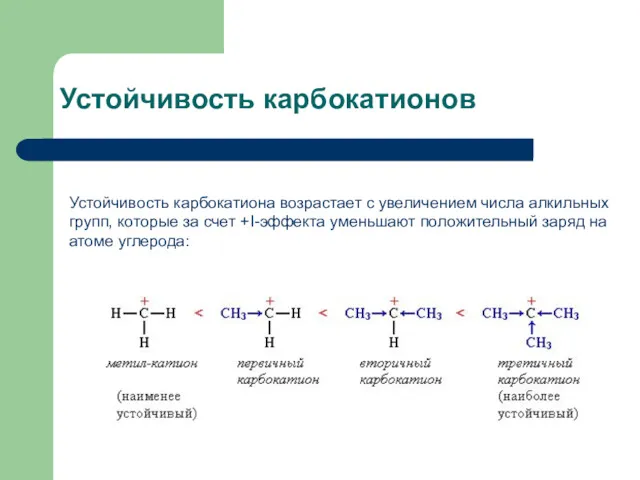
- 9. Устойчивость карбокатионов Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за счет +I-эффекта уменьшают положительный
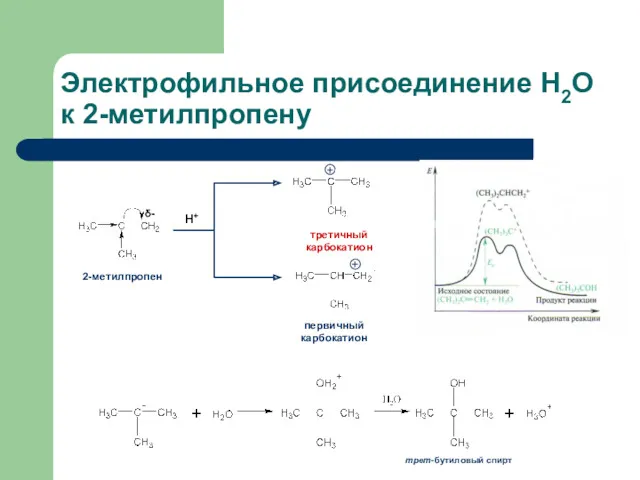
- 10. Электрофильное присоединение Н2О к 2-метилпропену
- 11. Перегруппировки карбокатионов Миграция метильной группы (1,2-сдвиг) может превратить первоначально образовавшийся вторичный карбокатион в более устойчивый третичный;
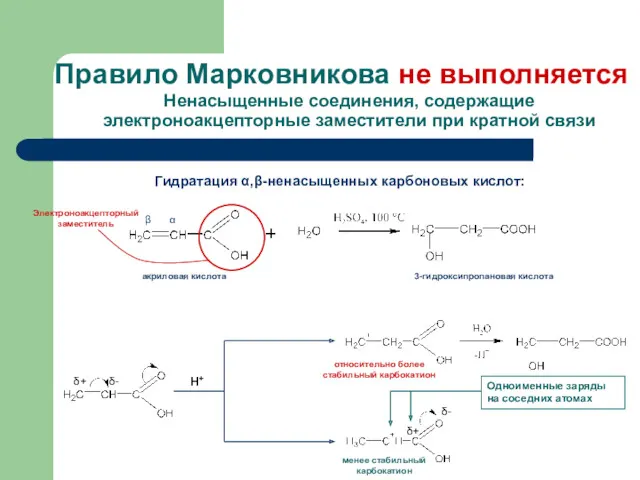
- 12. Правило Марковникова не выполняется Ненасыщенные соединения, содержащие электроноакцепторные заместители при кратной связи относительно более стабильный карбокатион
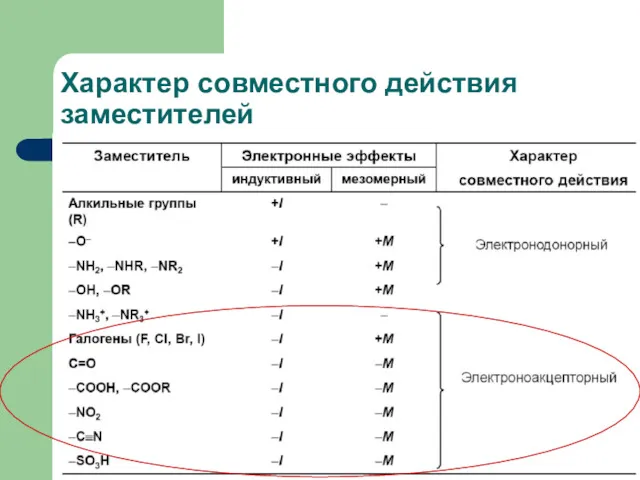
- 13. Характер совместного действия заместителей
- 14. Правило региоселективности АЕ ненасыщенных соединений Направление присоединения реагентов типа НХ к двойной углерод-углеродной связи несимметричных ненасыщенных
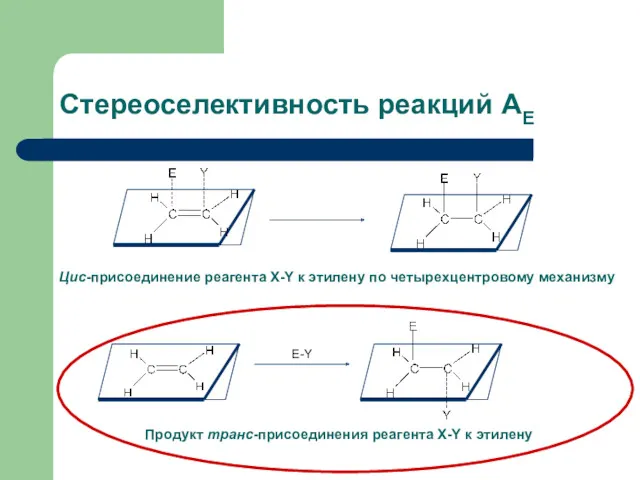
- 15. Стереоселективность реакций АЕ Е-Y Цис-присоединение реагента X-Y к этилену по четырехцентровому механизму Продукт транс-присоединения реагента X-Y
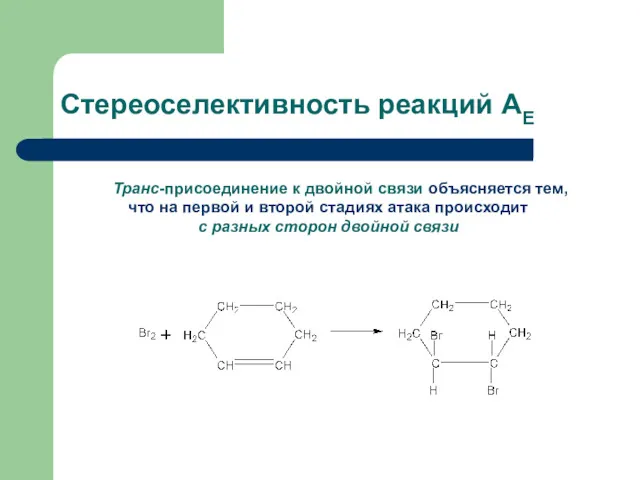
- 16. Стереоселективность реакций АЕ Транс-присоединение к двойной связи объясняется тем, что на первой и второй стадиях атака
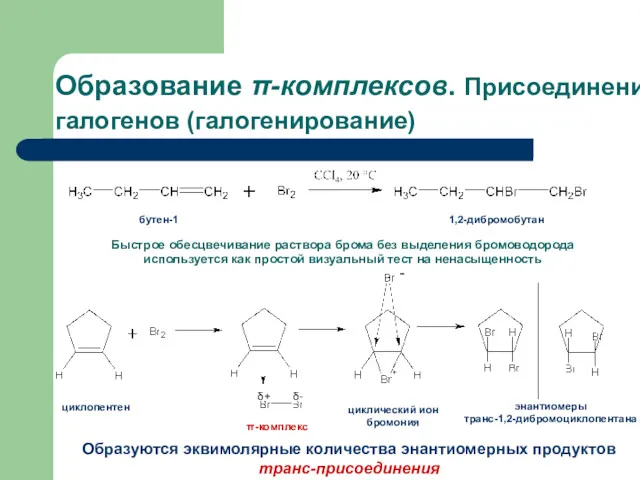
- 17. Образование π-комплексов. Присоединение галогенов (галогенирование) 1,2-дибромобутан бутен-1 Быстрое обесцвечивание раствора брома без выделения бромоводорода используется как
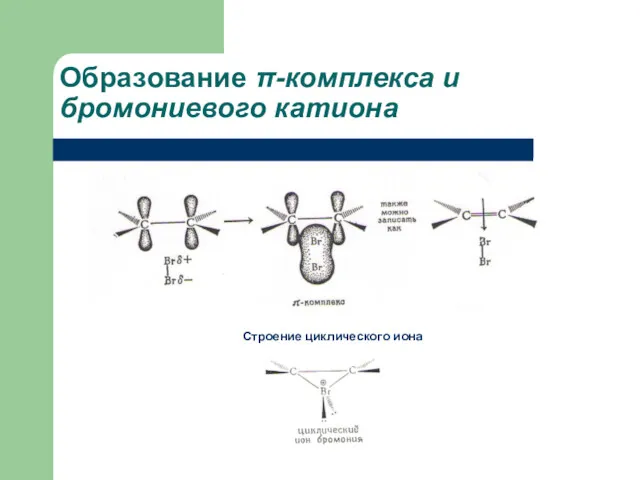
- 18. Образование π-комплекса и бромониевого катиона
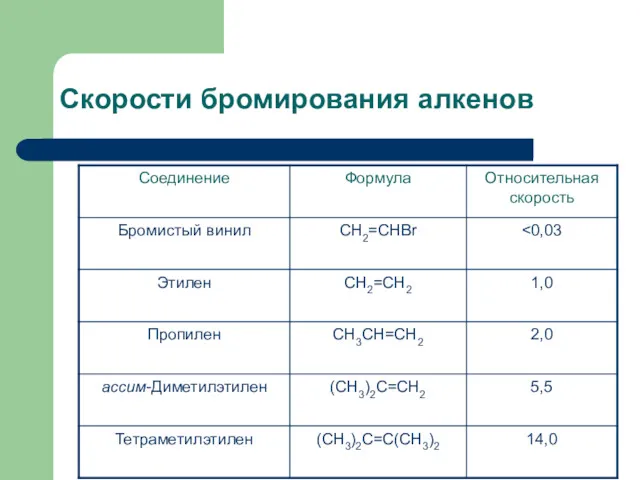
- 19. Скорости бромирования алкенов
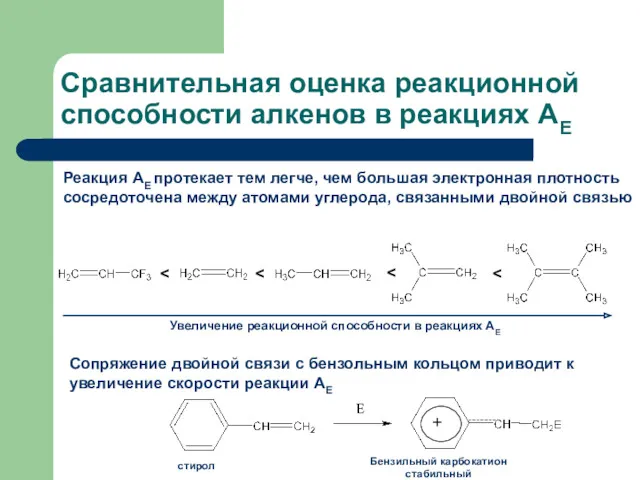
- 20. Сравнительная оценка реакционной способности алкенов в реакциях АЕ Реакция АЕ протекает тем легче, чем большая электронная
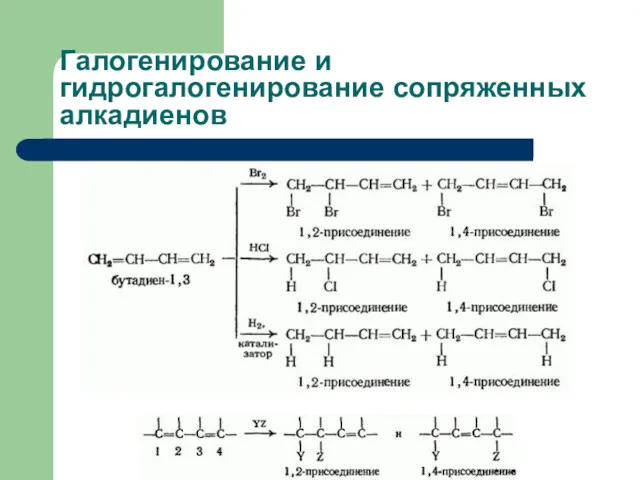
- 21. Галогенирование и гидрогалогенирование алкадиенов В диенах с изолированными двойными связями двойные связи реагируют независимо, т. е.
- 22. Галогенирование и гидрогалогенирование сопряженных алкадиенов
- 23. AЕ в сопряженных алкадиенах На первой стадии реакции образуется карбокатион I, а не II: Результаты эксперимента:
- 24. AЕ в сопряженных алкадиенах Как же можно объяснить то, что один из ионов предпочтительнее, хотя они
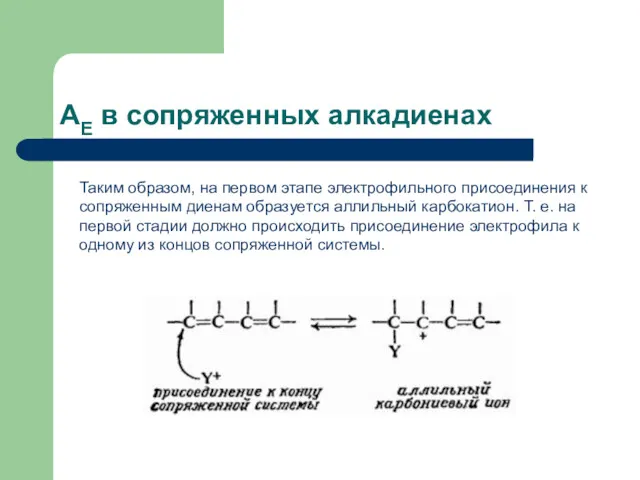
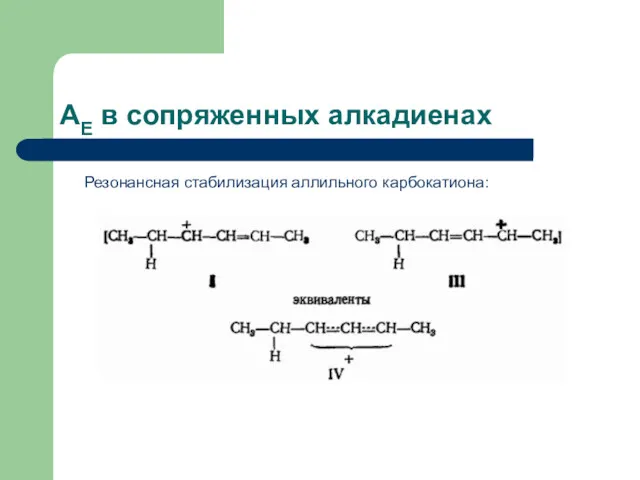
- 25. AЕ в сопряженных алкадиенах Таким образом, на первом этапе электрофильного присоединения к сопряженным диенам образуется аллильный
- 26. AЕ в сопряженных алкадиенах Резонансная стабилизация аллильного карбокатиона:
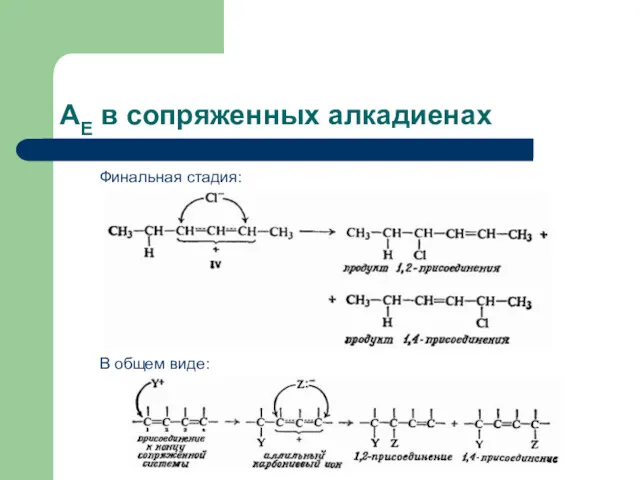
- 27. AЕ в сопряженных алкадиенах В общем виде: Финальная стадия:
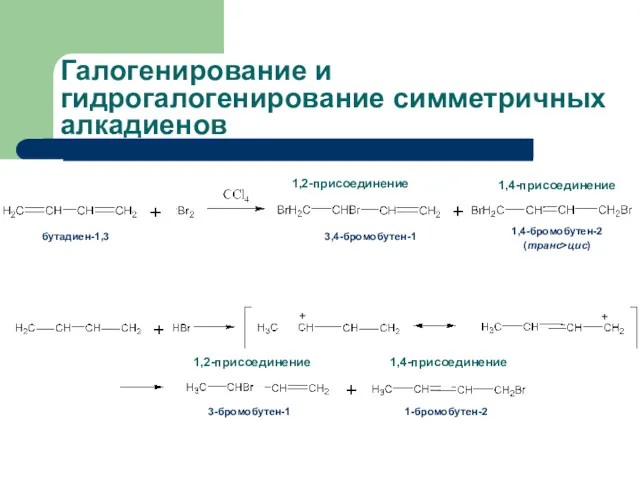
- 28. Галогенирование и гидрогалогенирование симметричных алкадиенов
- 29. Галогенирование симметричных алкадиенов: механизм реакции π-комплекс δ+ Карбокатион аллильного типа + 3,4-бромобутен-1 1,4-бромобутен-2 1,2-присоединение 1,4-присоединение +
- 30. Контроль реакций галогенирования и гидрогалогенирования алкадиенов 1,2-присоединение 1,4-присоединение Температура проведения реакции Содержание изомера в смеси 40
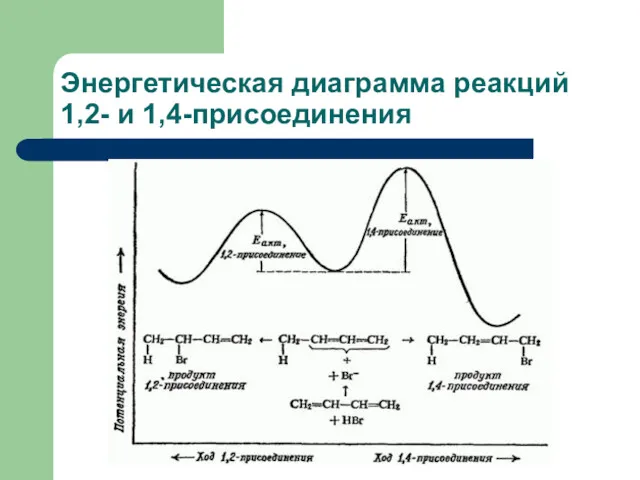
- 31. Энергетическая диаграмма реакций 1,2- и 1,4-присоединения
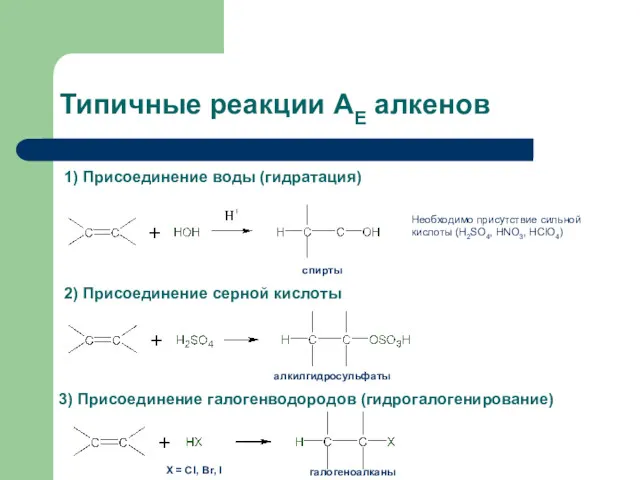
- 32. Типичные реакции АЕ алкенов 1) Присоединение воды (гидратация) 2) Присоединение серной кислоты 3) Присоединение галогенводородов (гидрогалогенирование)
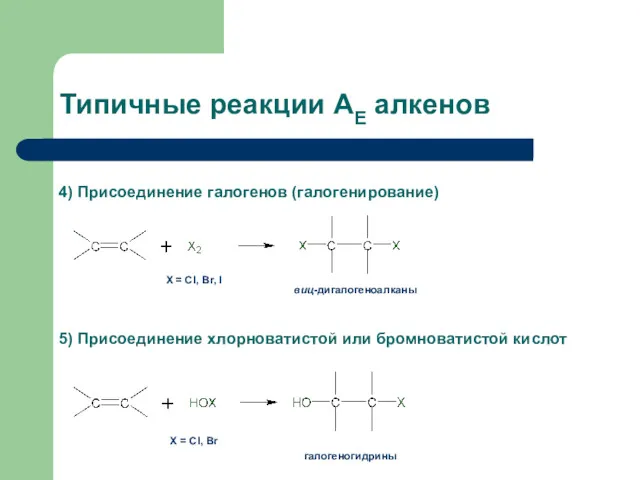
- 33. Типичные реакции АЕ алкенов Х = Cl, Br, I 4) Присоединение галогенов (галогенирование) виц-дигалогеноалканы 5) Присоединение
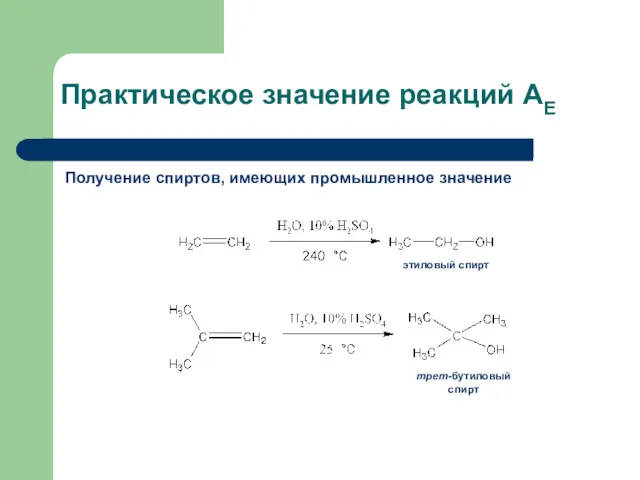
- 34. Практическое значение реакций АЕ Получение спиртов, имеющих промышленное значение этиловый спирт трет-бутиловый спирт
- 35. Получение вицинальных дигалогенидов
- 37. Скачать презентацию











 Аміни
Аміни Электронное строение атома
Электронное строение атома Оксиды. Физические и химические свойства
Оксиды. Физические и химические свойства Е-числа в школьном буфете
Е-числа в школьном буфете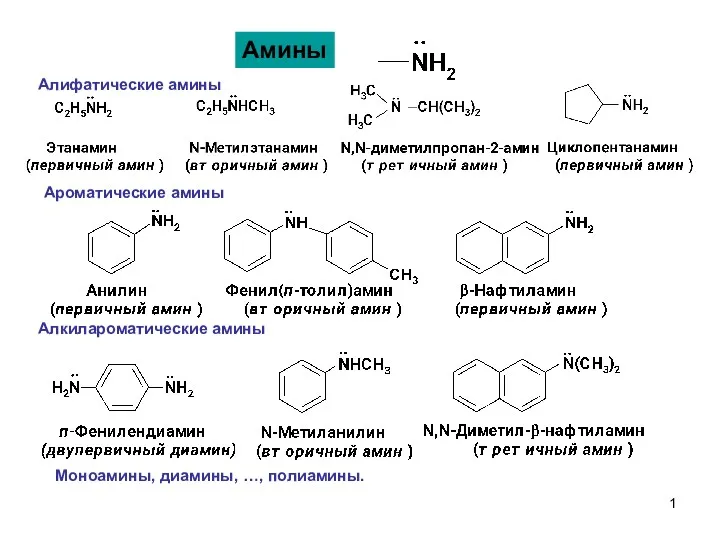 Амины-1
Амины-1 Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Художественная обработка металла
Художественная обработка металла Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс) Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс
Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Химическое равновесие
Химическое равновесие Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Химико-токсикологическое исследование кокаина
Химико-токсикологическое исследование кокаина Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Круговорот углерода в природе
Круговорот углерода в природе Кобальт. Химический элемент
Кобальт. Химический элемент Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Амин қышқылдар
Амин қышқылдар Свойства спирта и воды
Свойства спирта и воды Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Типы химических реакций
Типы химических реакций Нефть и способы ее переработки (10 класс)
Нефть и способы ее переработки (10 класс) Элементарные частицы вещества
Элементарные частицы вещества Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Алюминий и его соединения
Алюминий и его соединения