Содержание
- 2. О каком химическом элементе мы будем говорить?
- 3. В О Д О Р О Д
- 4. Цель урока: знакомство с химическим элементом и простым веществом водородом. Что мы хотим узнать? Как, когда
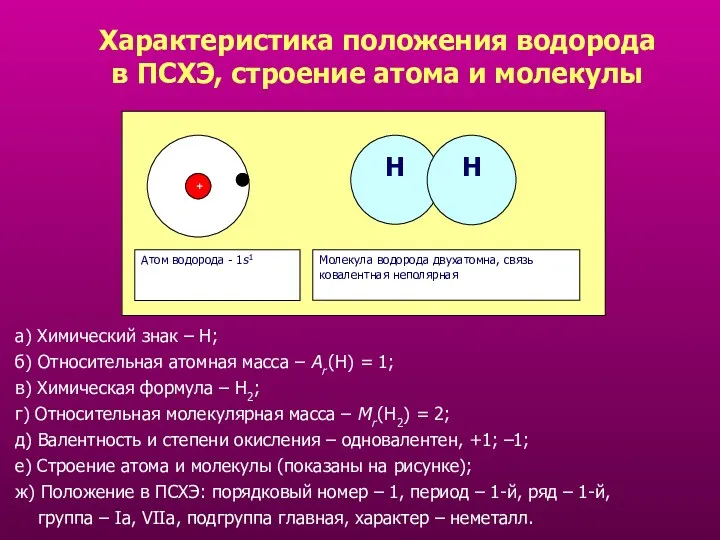
- 5. Характеристика положения водорода в ПСХЭ, строение атома и молекулы + Атом водорода - 1s 1 Н
- 6. XVIII век. Из истории открытия водорода… Генри Кавендиш Получил водород взаимодействием металлов и кислот и изучил
- 7. Водород – главный элемент космоса. На его долю приходится около 92 % всех атомов. Водород —
- 8. Нахождение водорода в природе Вода, нефть, природный газ, вулканические газы, органические соединения, атмосфера (очень мало), земная
- 9. Получение водорода в лаборатории Zn + 2HCl → ZnCl2 + H2↑
- 10. Гремучий газ – взрывоопасное вещество «Гремучий газ» – это смесь водорода и кислорода в объемном отношении
- 11. Способы собирания водорода методом вытеснения воды методом вытеснения воздуха
- 12. в промышленности А. Электролизом воды и водных растворов щелочей и солей 2H2O = 2H2 + O2
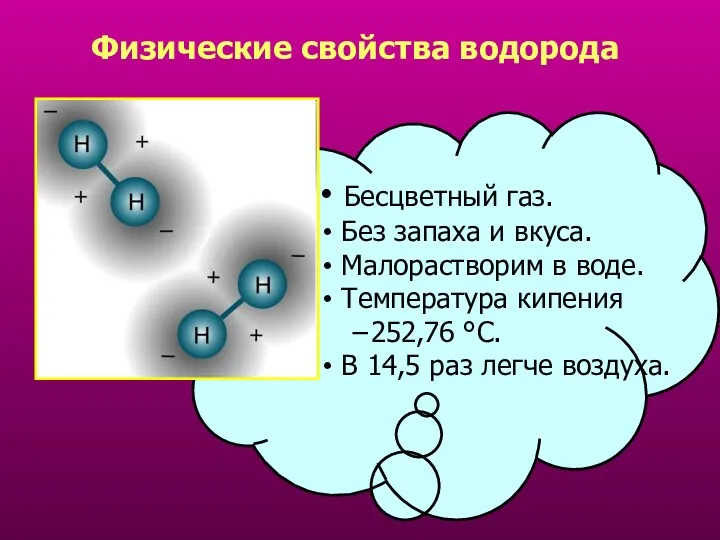
- 13. Физические свойства водорода Бесцветный газ. Без запаха и вкуса. Малорастворим в воде. Температура кипения −252,76 °C.
- 14. Химические свойства водорода. Водород – восстановитель. Горит в кислороде: 2H2 + O2 = 2H2O Просмотр видео
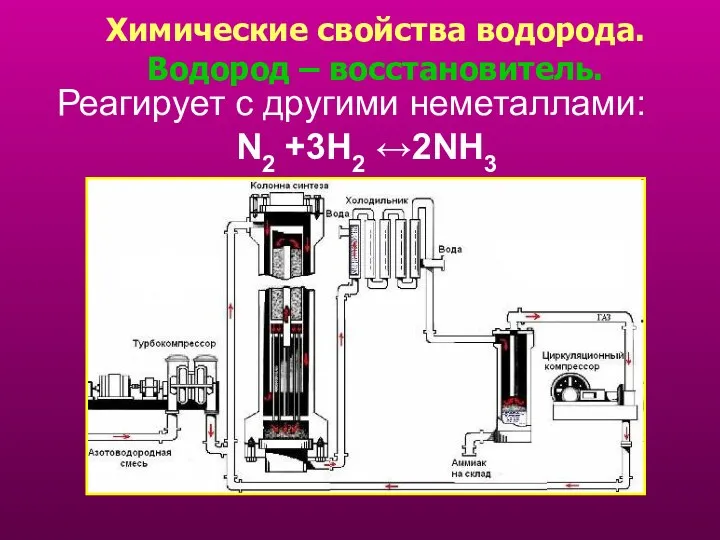
- 15. Реагирует с другими неметаллами: N2 +3H2 ↔2NH3 Химические свойства водорода. Водород – восстановитель.
- 16. Взаимодействие водорода с оксидом меди(II) СuO + H2 = Cu + H2O Просмотр видео
- 17. Реагирует со щелочными и щелочно-земельными металлами с образованием гидридов: 2K + H2 = 2KH (гидрид калия);
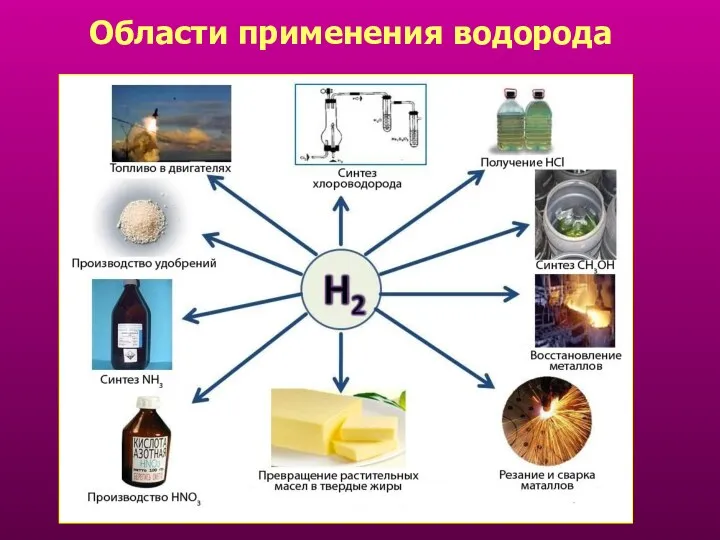
- 18. Области применения водорода Просмотр видео
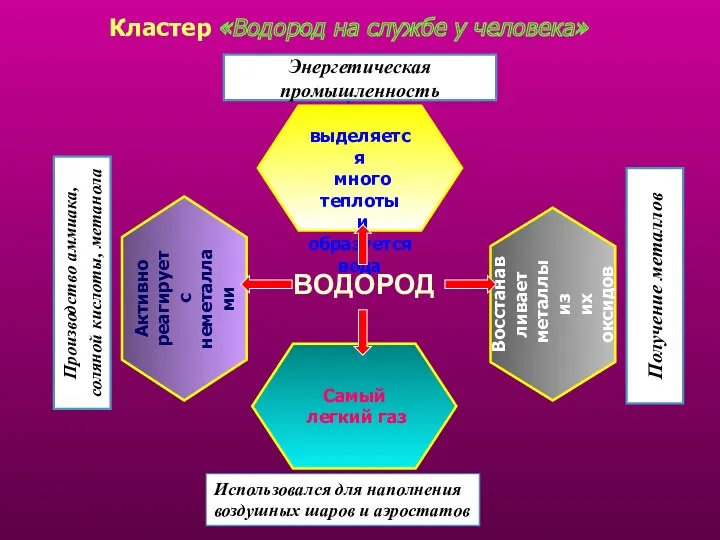
- 19. Кластер «Водород на службе у человека» Самый легкий газ При сгорании выделяется много теплоты и образуется
- 20. Летучий, но горючий… Наработав в достаточном количестве этот легкий газ, люди сначала приспособили его для воздушных
- 21. Водород – альтернативный источник энергии… Энергетики и ученые считают, что в недалеком будущем водород станет идеальным
- 22. ...в человеческом организме водорода содержится 10 %, или около 7 кг. …для получения маргарина используют растительные
- 23. Тест «Водород и его свойства» 1. Какое из утверждений не относится к водороду? а) относительная молекулярная
- 24. Тест «Водород и его свойства» 2. Укажите причину, по которой водород считается топливом будущего: а) при
- 25. Тест «Водород и его свойства» 3. В промышленности водород получают: а) из метана; б) из воздуха;
- 26. Тест «Водород и его свойства» 4. Водород в лаборатории получают взаимодействием: а) железа с водой; б)
- 27. Тест «Водород и его свойства» 5. Опаснее всего подносить горящую спичку к сосуду, где находится: а)
- 28. Тест «Водород и его свойства» 6. Водород взаимодействует с: а) основными и кислотными оксидами; б) кислотными
- 29. Тест «Водород и его свойства» 7. Водород не реагирует с: а) азотом; б) серой; в) гелием;
- 30. Тест «Водород и его свойства» 8. При повышенной температуре водород не реагирует с: а) хлором; б)
- 31. Тест «Водород и его свойства» Правильные ответы
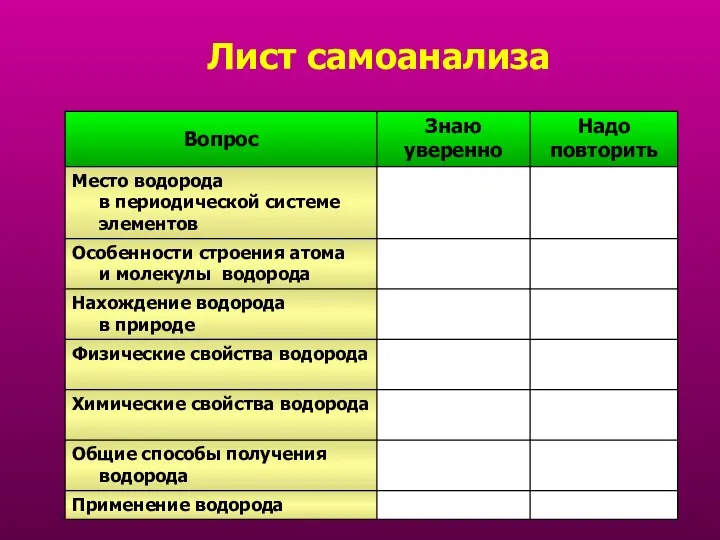
- 32. Лист самоанализа
- 34. Скачать презентацию

























 Сравнительная характеристика галогенов
Сравнительная характеристика галогенов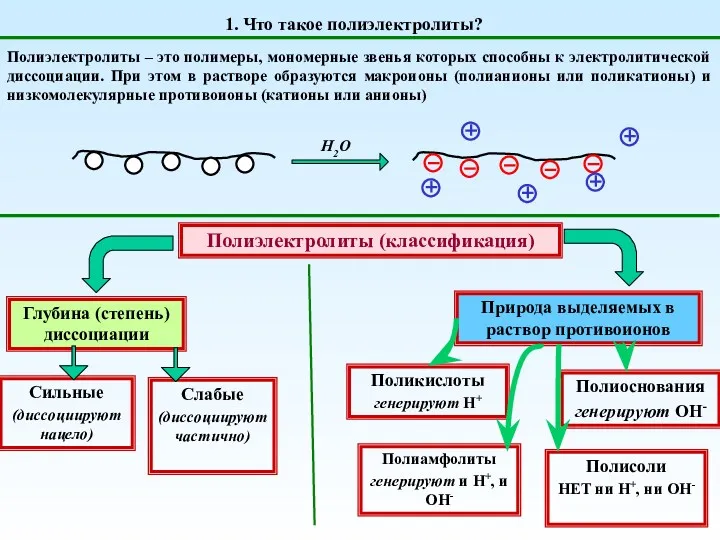 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов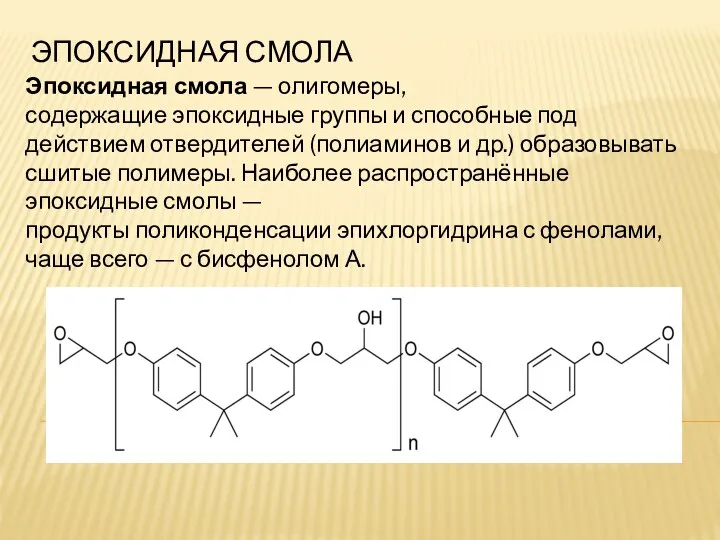 Эпоксидная смола
Эпоксидная смола Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины Щёлочноземельные металлы
Щёлочноземельные металлы Спирты. Определение. Классификация
Спирты. Определение. Классификация Кислотно-основное титрование
Кислотно-основное титрование Химический элемент и вещество
Химический элемент и вещество Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Фосфор и его соединения
Фосфор и его соединения Алюминий на кухне - опасный враг или верный помощник?
Алюминий на кухне - опасный враг или верный помощник?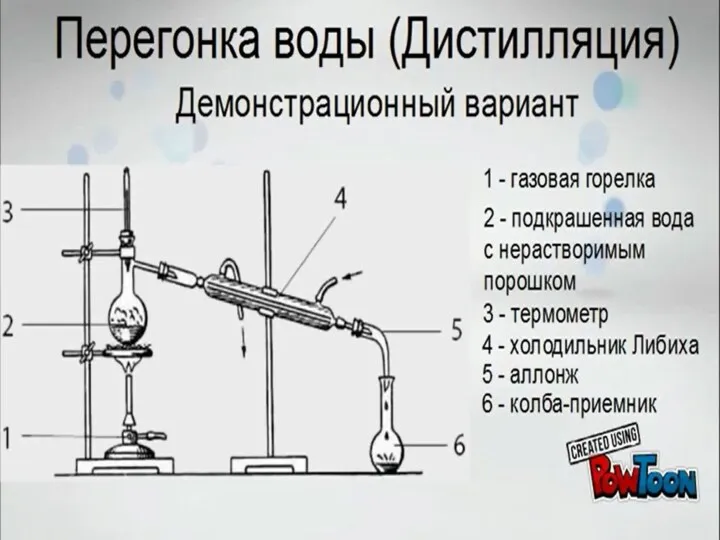 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Атом - сложная частица
Атом - сложная частица Горные породы
Горные породы Алкины. Ацетилен.
Алкины. Ацетилен. Спектрофометрия
Спектрофометрия Воздух, которым мы дышим
Воздух, которым мы дышим Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Щелочные металлы
Щелочные металлы Качественные реакции
Качественные реакции Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ