Слайд 2

А. Беккерель
1853–1908 гг.
В 1896 г. открыл явление радиоактивности (самопроизвольный распад
атомов некоторых элементов).
Слайд 3

Э. Резерфорд
1871–1937 гг.
В 1899–1903 гг. установил природу
α-, β- и
γ-лучей, образующихся
при радиоактивном распаде.
В 1899–1903 гг. открыл ядра атомов.
Слайд 4

Р. Милликен
1868–1953 гг.
В 1909 г. Определил заряд электрона.
Слайд 5

Дж. Томпсон
1856–1940 гг.
В 1904 г. в работе «О структуре атома»
дал описание своей модели, получившей образное название «пудинг с изюмом».
Слайд 6

Планетарная модель
атома Резерфорда
Суть планетарной модели
строения атома:
1. В центре атома
находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти
вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Слайд 7

Планетарная модель
атома Резерфорда
Электрон, двигаясь вокруг ядра с ускорением, должен был
бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и в конце концов упасть на него.
Слайд 8

Н. Бор
1885–1962 гг.
Датский физик. В 1913 г. предложил свою теорию
строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца.
В 1912 г. Дж. Франк и Г. Герц доказали дискретность энергии электрона в атоме, что позволило Бору положить в основу новой теории два необычных предположения.
Слайд 9

Постулаты теории Н. Бора
1. Электрон может вращаться вокруг ядра не по
произвольным, а только по строго определенным (стационарным) круговым орбитам.
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии.
Слайд 10

Н. Бор
1885–1962 гг.
Внёс квантовые представления в строение атома, но использовал
при этом традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определённой скоростью по строго определённым траекториям.
Слайд 11
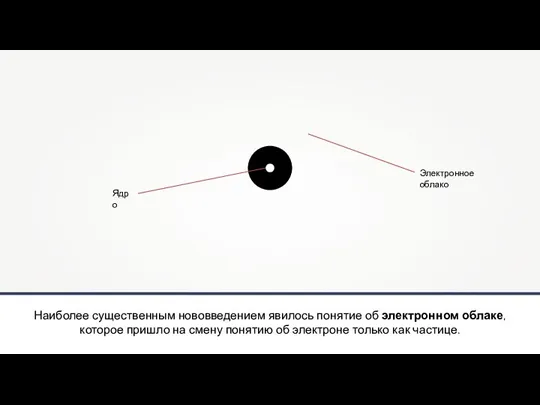
Слайд 12
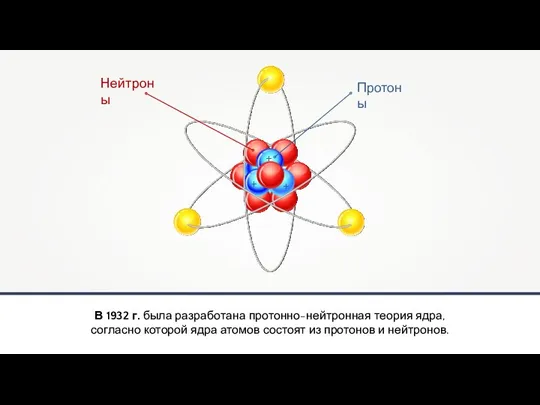
Слайд 13

Слайд 14

Слайд 15

n=A-p
n — число нейтронов
A — массовое число
p — число протонов
Слайд 16
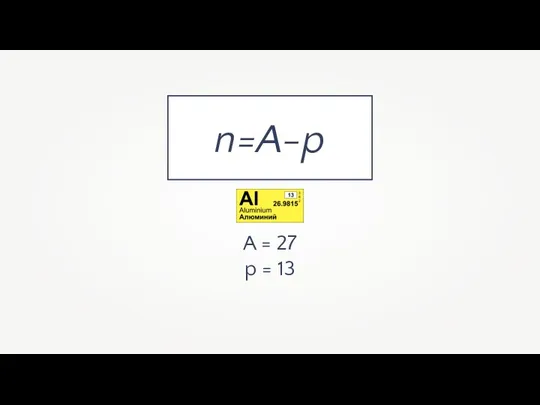
Слайд 17

Слайд 18

Слайд 19
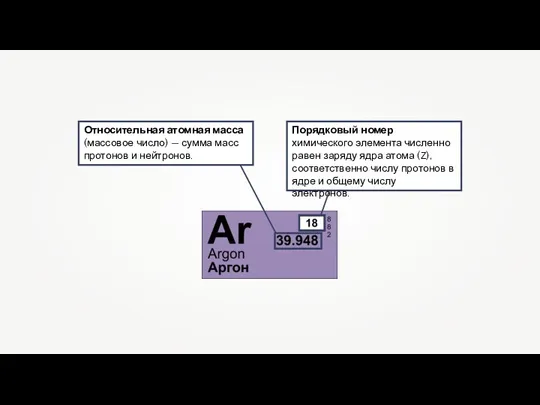
Слайд 20



















 Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен
Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен Классификация химических реакций
Классификация химических реакций Металлы побочных подгрупп. Марганец. Хром. (Лекция 15)
Металлы побочных подгрупп. Марганец. Хром. (Лекция 15) Protein Chemistry
Protein Chemistry Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Гибкость цепи полимеров
Гибкость цепи полимеров Реакции ионного обмена
Реакции ионного обмена Природный и искусственный камень
Природный и искусственный камень Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Хром. Физические свойства и применение
Хром. Физические свойства и применение Пищевые добавки
Пищевые добавки Фенол қосылыстары
Фенол қосылыстары Классификация органических соединений
Классификация органических соединений Этот многоликий цинк
Этот многоликий цинк Мартенситное превращение
Мартенситное превращение Минералы. Классификация минералов
Минералы. Классификация минералов Решение задач. Органическая химия
Решение задач. Органическая химия фосфор
фосфор Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Crystal Defects and Noncrystalline Structure–Imperfection
Crystal Defects and Noncrystalline Structure–Imperfection Физико-химические свойства жиров
Физико-химические свойства жиров Центрифугирование в цитологии
Центрифугирование в цитологии Минералы. Свойства минералов
Минералы. Свойства минералов Elements of group 2 (IIA)
Elements of group 2 (IIA)