Содержание
- 2. Функциональная группа – это атом или группа атомов неуглеводородного характера, которые определяют принад-лежность соединения к определённому
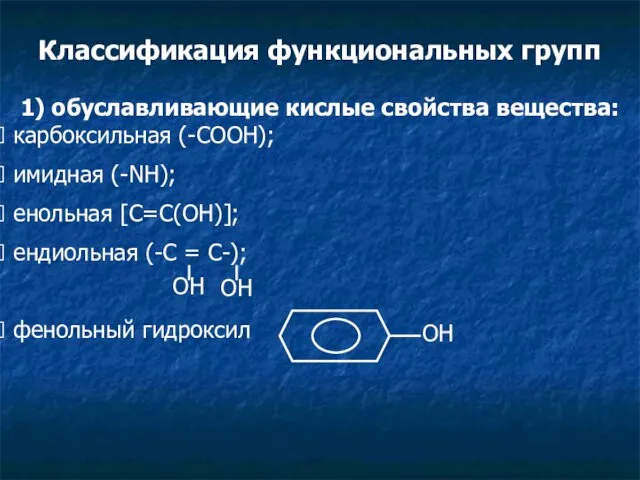
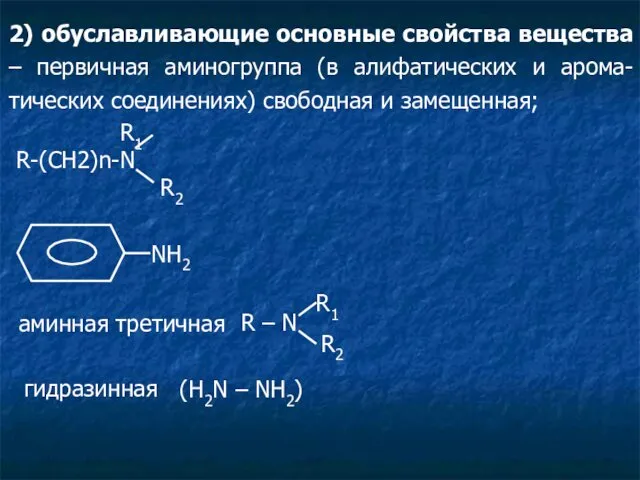
- 3. Классификация функциональных групп 1) обуславливающие кислые свойства вещества: карбоксильная (-СООН); имидная (-NH); енольная [C=C(OH)]; ендиольная (-С
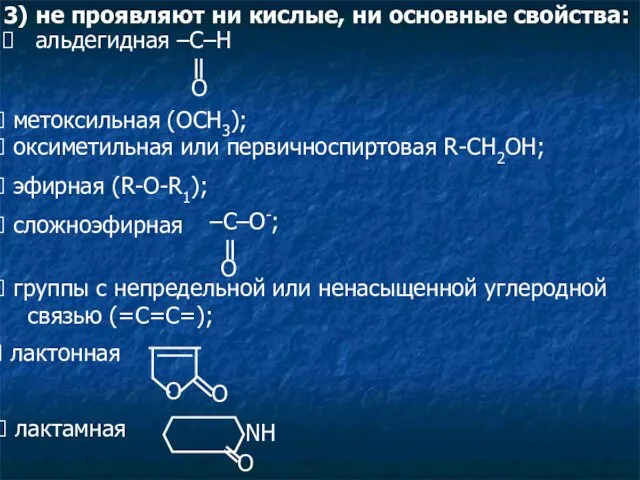
- 5. 3) не проявляют ни кислые, ни основные свойства: метоксильная (ОСН3); оксиметильная или первичноспиртовая R-CH2OH; эфирная (R-O-R1);
- 6. C2H5OH + CH3COOH C2H5О – C – CH3 + H2O КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ФУНКЦИОНАЛЬНЫЕ ГРУППЫ I.
- 7. II. Гидроксильная группа – фенольная. Лекарственные средства, содержащие фено-льную группу: салициловая кислота; ацетилсалициловая кислота; салицилат натрия;
- 8. III. Карбонильная группа – альдегидная. Лекарственные средства: глюкоза; раствор формальдегида. Реакция «серебряного зеркала» AgNO3 + 3NH4OH
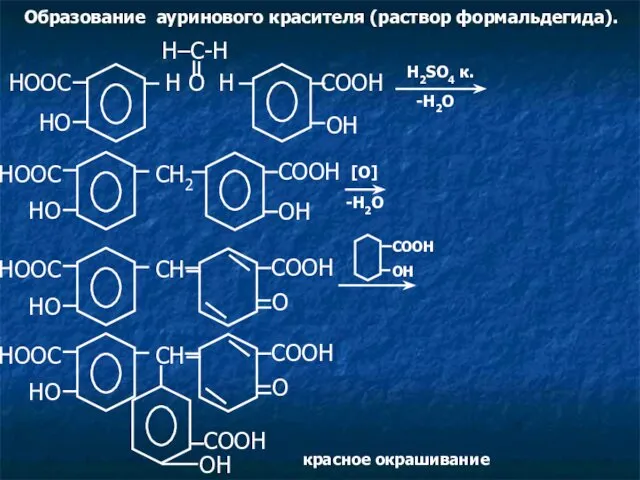
- 9. Образование ауринового красителя (раствор формальдегида). HOOC CH HO O COOH OH COOH красное окрашивание
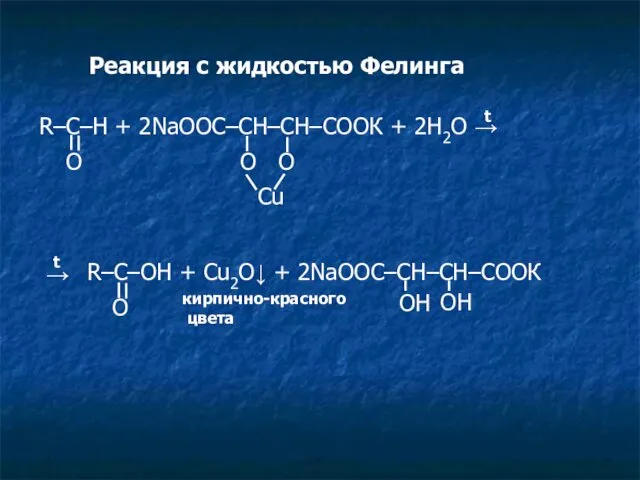
- 10. Реакция с жидкостью Фелинга R–C–H + 2NaOOC–CH–CH–COOК + 2H2O → O O O Cu t O
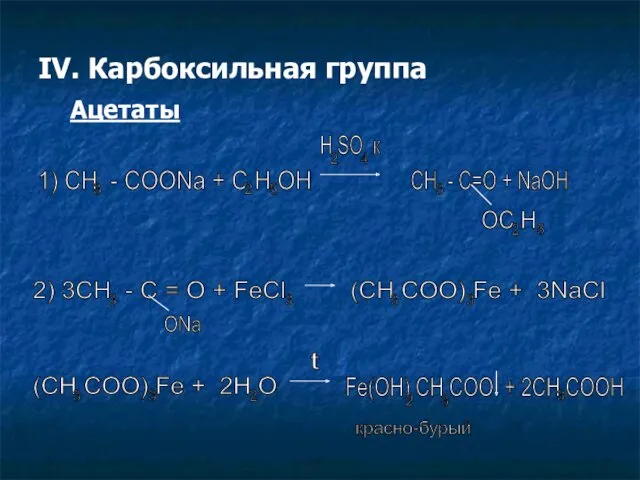
- 11. IV. Карбоксильная группа Ацетаты 1) CH - COONa + C H OH 3 2 5 H
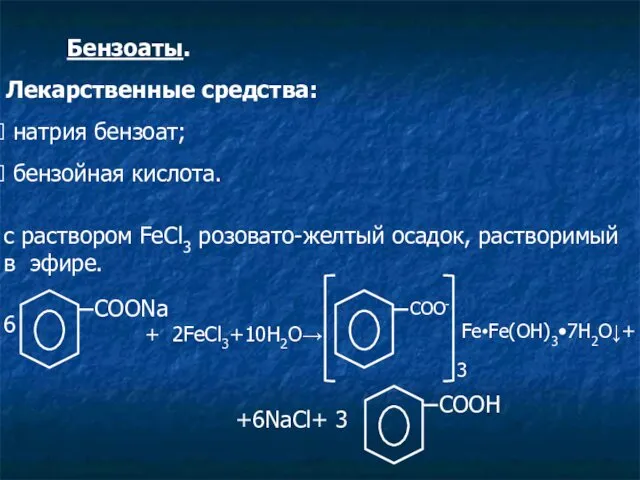
- 12. Бензоаты. Лекарственные средства: натрия бензоат; бензойная кислота. c раствором FeCl3 розовато-желтый осадок, растворимый в эфире. 6
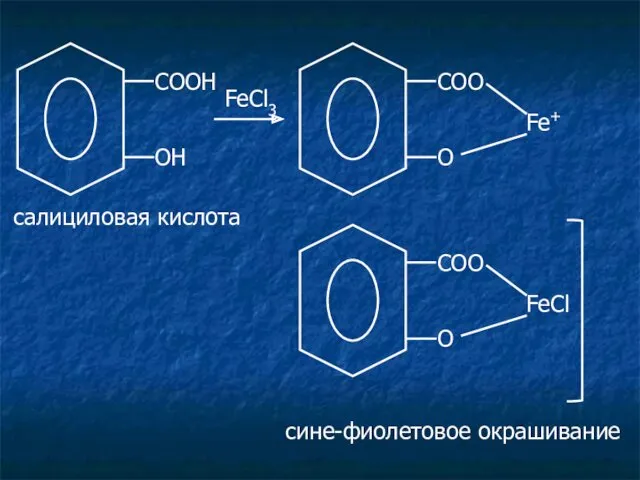
- 13. Салицилаты. Лекарственные средства: салициловая кислота; натрия салицилат. c раствором FeCl3 появляется сине-фиолетовое или красное окрашивание, сохраняется
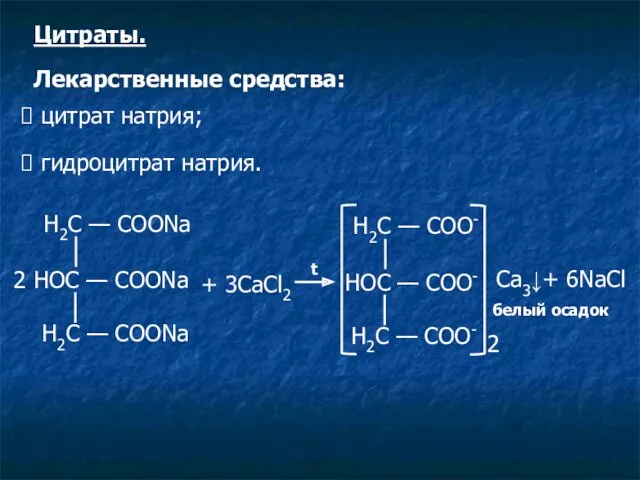
- 15. Н2С — СООNa 2 НOС — СООNa Н2С — СООNa + 3CaCl2 t Н2С — СОО-
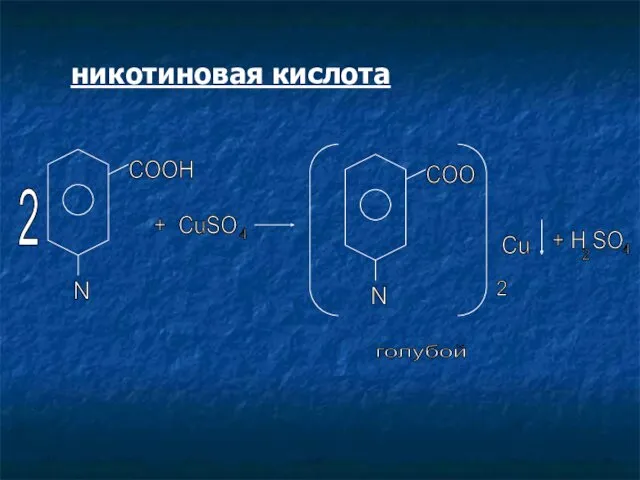
- 16. никотиновая кислота N 2 COOH + CuSO 4 N COO 2 Cu + H SO 2
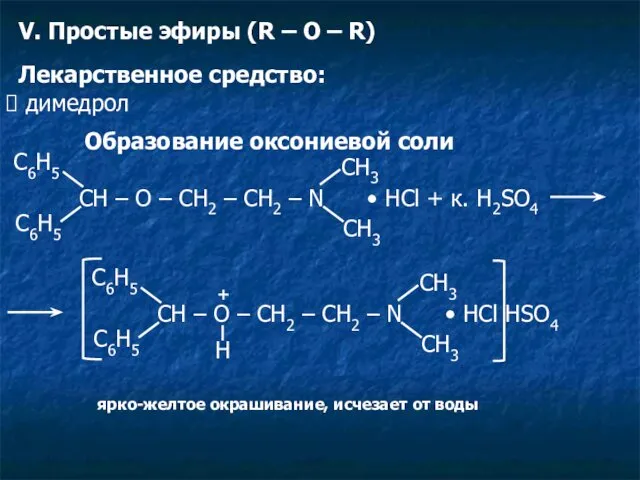
- 17. V. Простые эфиры (R – O – R) Лекарственное средство: димедрол Образование оксониевой соли CH –
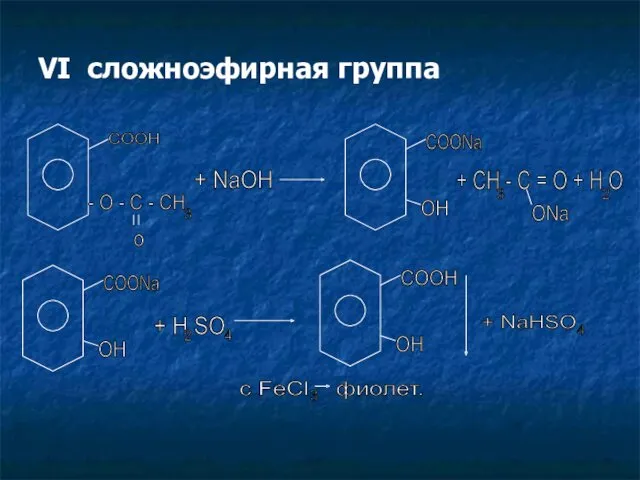
- 18. VI сложноэфирная группа COOH - O - C - CH 3 o + NaOH COONa OH
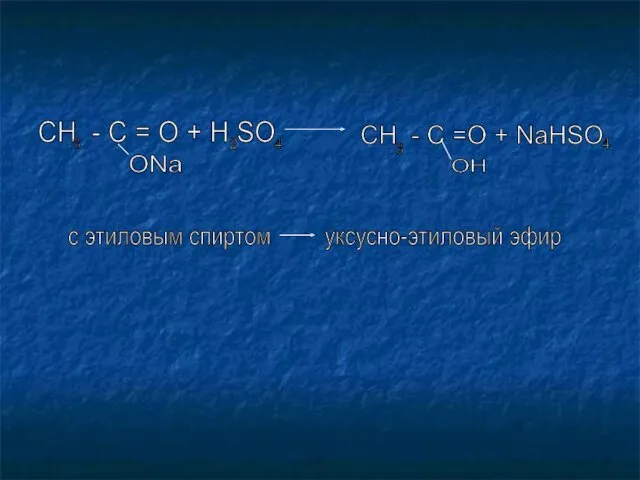
- 19. CH - C = O + H SO 3 ONa 2 4 CH - C =O
- 20. VII. Амины ароматические первичные (R – NH2) Лекарственные средства: анестезин; новокаин; стрептоцид; норсульфазол; сульфацил натрия; натрия
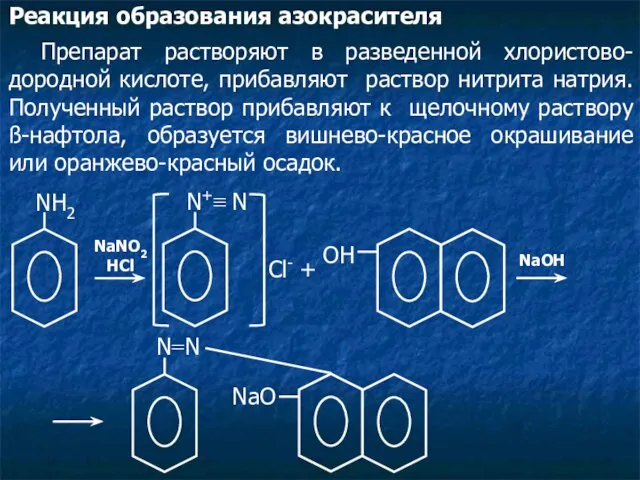
- 21. Реакция образования азокрасителя Препарат растворяют в разведенной хлористово-дородной кислоте, прибавляют раствор нитрита натрия. Полученный раствор прибавляют
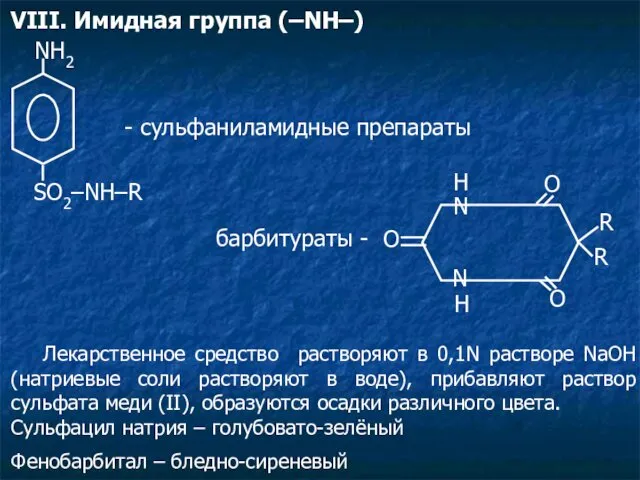
- 22. VIII. Имидная группа (–NH–) NH2 SO2–NH–R - сульфаниламидные препараты O N N O R R O
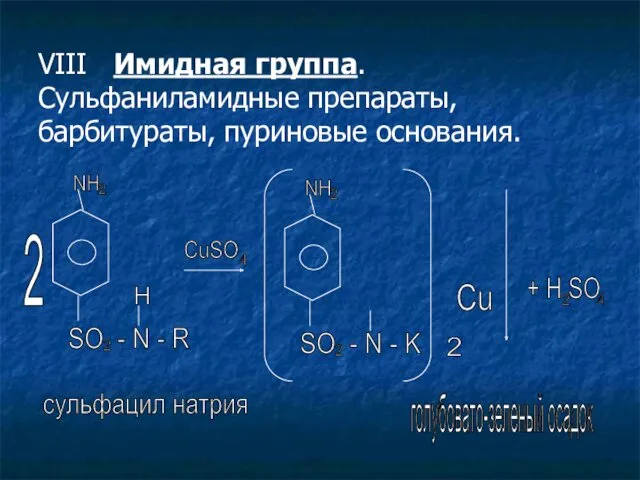
- 23. VIII Имидная группа. Сульфаниламидные препараты, барбитураты, пуриновые основания. 2 NH 2 SO - N - R
- 24. Кислотно-основное титрование в неводных средах Определяют вещества, которые в водной среде невозможно определить методом нейтрализации Из-за
- 25. МЕТОД НЕВОДНОГО ТИТРОВАНИЯ Классификация растворителей Амфитропные или амфотерные: H2O, CH3OH, C2H5OH и другие. Эти растворители играют
- 26. 3) Протофильные или основные: NH3, H2N-NH2, H2N(CH2)2NH2, HCON(CH3)2 и другие вещества основного характера. Молекулы протофильных растворителей
- 27. Преимущество метода кислотно-основного титрования в неводных средах состоит и в том, что он позволяет определять соли
- 28. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОСНОВАНИЙ И ИХ СОЛЕЙ. HClO4 + CH3COOH → ClO4- + CH3COOH2+ кислота основание ион
- 29. Реакция нейтрализации сопровождается образо-ванием молекул того растворителя, в среде которого протекает данная реакция. 1) HClO4 +
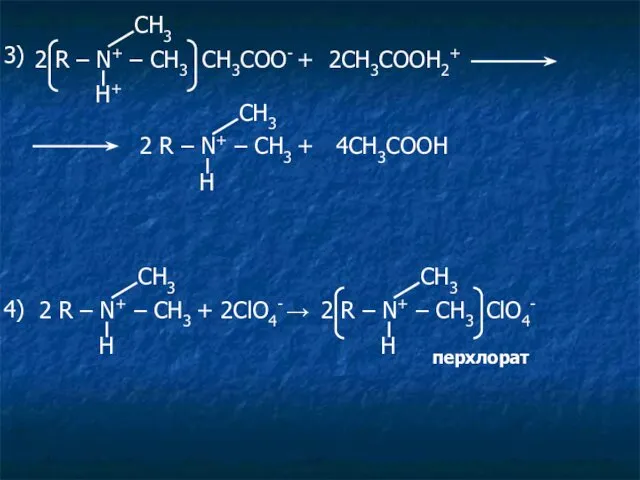
- 30. 2 R – N+ – CH3 CH3COO- + 2CH3COOH2+ Н+ СН3 3) Н СН3 2 R
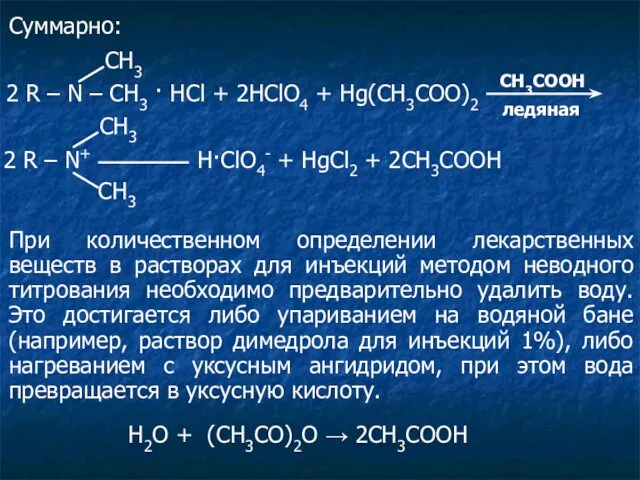
- 31. Суммарно: 2 R – N – CH3 · HCl + 2HClO4 + Hg(CH3COO)2 СН3 CH3COOH ледяная
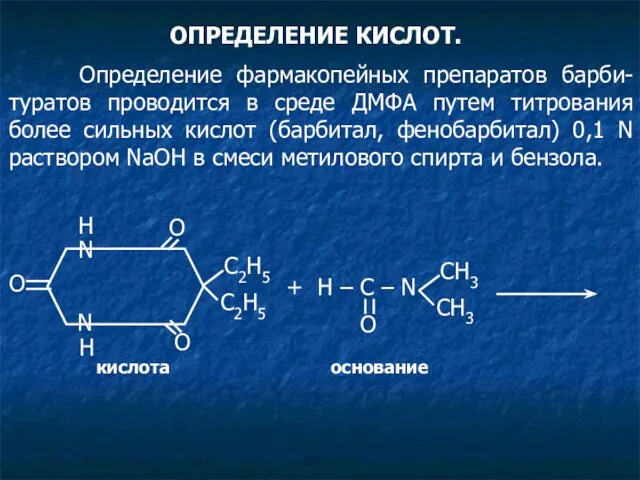
- 32. ОПРЕДЕЛЕНИЕ КИСЛОТ. Определение фармакопейных препаратов барби-туратов проводится в среде ДМФА путем титрования более сильных кислот (барбитал,
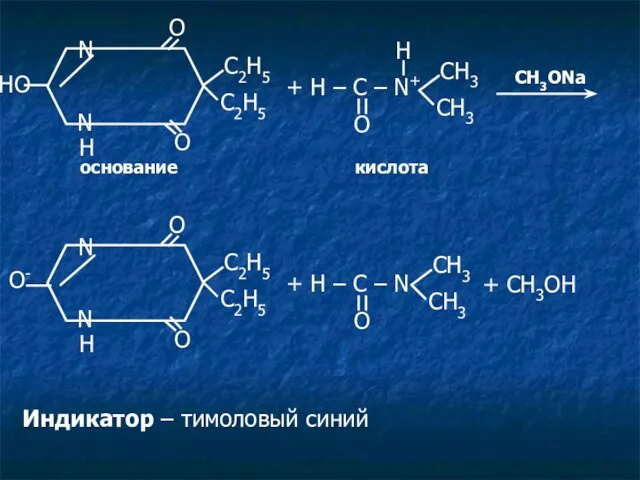
- 33. HO N N O С2Н5 O H С2Н5 + H – C – N+ O СН3
- 35. Скачать презентацию












 Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Зелёная химия
Зелёная химия Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Свойства органических соединений
Свойства органических соединений Коллигативные свойства растворов
Коллигативные свойства растворов Драгоценные камни
Драгоценные камни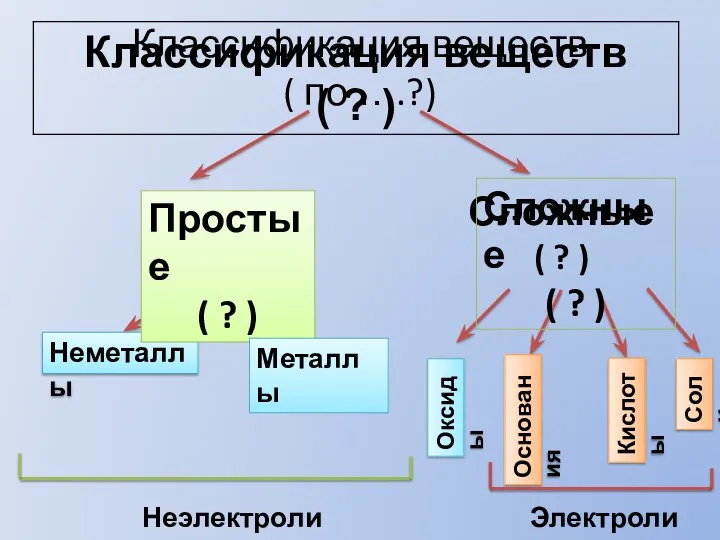 Классификация веществ
Классификация веществ Титриметрический анализ
Титриметрический анализ Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Аминокилоты. Свойства
Аминокилоты. Свойства Синтетические моющие средства
Синтетические моющие средства Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Основные понятия и законы химии
Основные понятия и законы химии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Арены
Арены Липиды (Жиры)
Липиды (Жиры) Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Капиллярная конденсация
Капиллярная конденсация Количественное определение лекарственных веществ
Количественное определение лекарственных веществ