Содержание
- 2. ЦЕЛИ УРОКА Рассмотреть положение алюминия в Периодической системе элементов. Ознакомить учащихся с нахождением алюминия в природе,
- 3. Изучаемые вопросы Алюминий как химический элемент: положение в Периодической системе, строение атома, электроотрицательность, Нахождение в природе.
- 4. Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Был впервые получен датским физиком
- 5. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
- 6. Число протонов p+=13 нейтронов n0=14 электронов ē=13
- 7. Изотопы алюминия В природе представлен лишь один стабильный изотоп 27Al. Искусственно получен ряд радиоактивных изотопов алюминия,
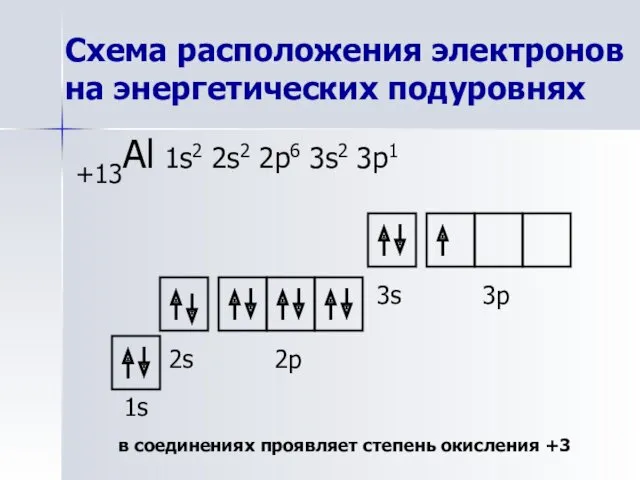
- 8. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 9. Al – типичный металл Схема образования вещества Al 0- 3ē ↔ Al+3 Тип химической связи -металлическая
- 10. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 11. Химические свойства вещества Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду
- 12. Алюминий реагирует: 1. 4Al+3O2 = 2Al2O3 + Q – покрывается пленкой оксида, но в мелкораздроблен-ном виде
- 13. Алюминий реагирует: 6. С водой при удалении с поверхности оксидной пленки 2 Al + 6Н2O =
- 14. Пассивация поверхности Концентрированные азотная и серная кислоты на холоде пассивируют алюминий, упрочняя защитную пленку на его
- 15. Получение вещества Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около
- 16. Домашнее задание: И.И.Новошинский, Н.С.Новошинская С. 182-185 Задания 1-3,5,6.
- 17. Соединения алюминия Цели урока: ознакомить учащихся с соединениями алюминия. Сформировать знания о свойствах его оксида и
- 18. Соединения алюминия Изучаемые вопросы: соединения алюминия, их состав и способы получения. Амфотерность оксида и гидроксида алюминия.
- 19. Оксид алюминия Al2О3: Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в
- 20. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 21. Качественная реакция на ион Al3+ Реактивом на ионы Al3+ являются ионы OH- При действии раствора щелочи
- 22. Применение Al
- 23. Ряд факторов применения алюминия: Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Обладает
- 24. Влияние соединений алюминия на загрязнение окружающей среды. Почти все загрязняющие вещества, которые первоначально попали в атмосферу,
- 25. Металл будущего Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов
- 27. Скачать презентацию























 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов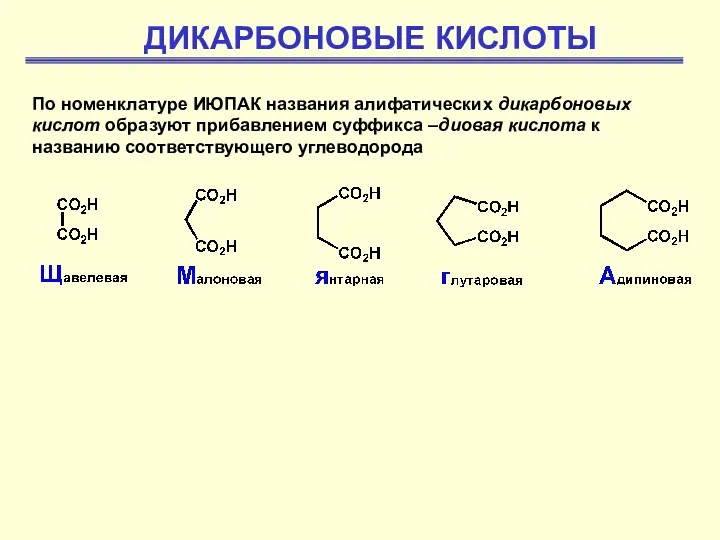 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка