Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар презентация
Содержание
- 2. Жоспар 1) Органикалық қосылыстар дегеніміз не? Органикалық қосылыстардың жіктелуі. 2) Органикалық қосылыстардың изомериясы және номенклатурасы. 3)
- 3. Органикалық химия (ОХ) ОХ - көмірсутектер және олардың туындыларының қасиеттерін, құрамын және құрылымын зерттейтін ғылым органикалық
- 4. Биоорганикалық химия БиоОХ- тірі организмдегі процестердің негізінде жататын заттарды, олардың биологиялық функцияларымен тікелей байланыстыра қарастырады. Организмді
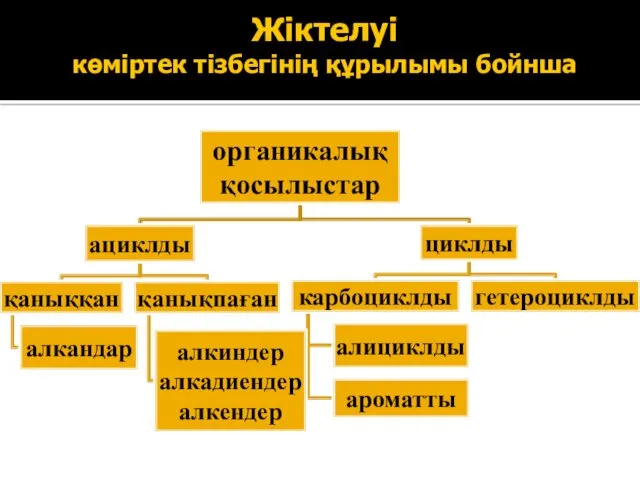
- 5. Жіктелуі көміртек тізбегінің құрылымы бойнша
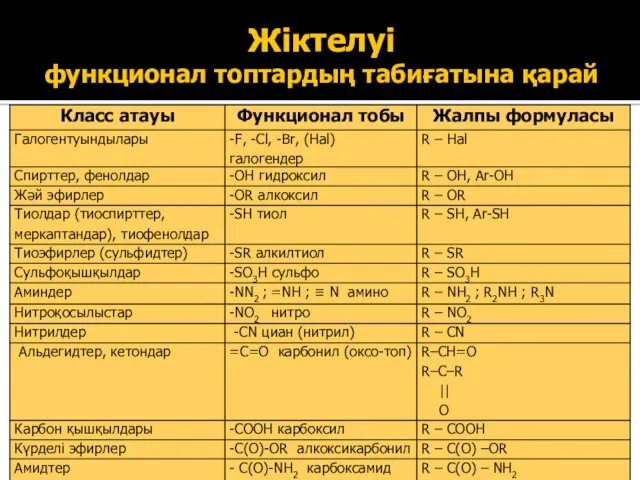
- 6. Жіктелуі функционал топтардың табиғатына қарай
- 7. Жіктелуі Бір функционал тобы бар қосылыстар аталады монофункционалды бірнеше функционал тобы болса – полифункционалды әр түрлі
- 8. Химиялық байланыс ОҚ байланыстардың негізгі түрі коваленттік байланыс, яғни байланысатын атомдардың электрондарының жұптасуынан түзілетін химиялық байланыс
- 9. Номенклатура Әрбір жеке қосылысты атауға мүмкіндік беретін ережелер жүйесін – номенклатура деп атайды. ИЮПАК (IUРАС –теориялық
- 10. Номенклатуралық терминдер Молекуланың аталуын қою үшін қосылыс келесі құрылымдық элементтерді бөледі: көмірсутекті радикал бастаушы құрылым орынбасушы
- 11. Көмірсутекті радикал – бір немесе бірнеше сутек атомын алғанда, бір немесе бірнеше валенттілігі бос қалған, молекула
- 12. Номенклатуралық терминдер Бастаушы құрылым – басты көміртек тізбегі және карбо – және гетероциклдердегі циклды құрылым. Орынбасушы
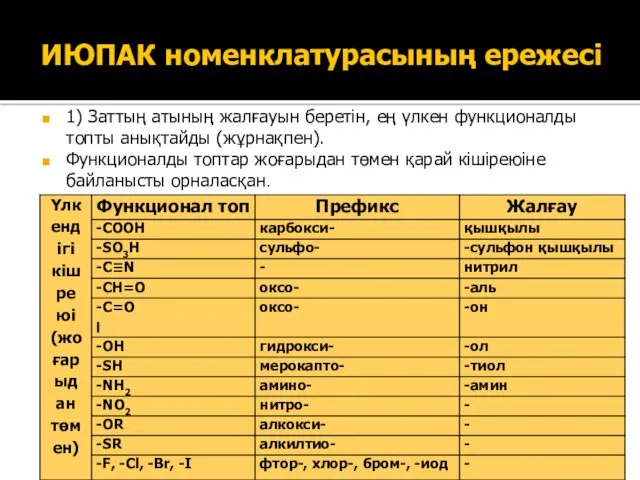
- 13. 1) Заттың атының жалғауын беретін, ең үлкен функционалды топты анықтайды (жұрнақпен). Функционалды топтар жоғарыдан төмен қарай
- 14. ИЮПАК номенклатурасының ережесі 2) Бастапқы құрлысын анықтайды. Ол үшін ен ұзын неғұрлым көп орынбасушысы, қанықпаған байланыстары
- 15. ИЮПАК номенклатурасының ережесі 5) Алфавит ретімен аталатын орынбасушылардың (кіші функционал топтар - префикстер, көміртегісіз орынбасушылар, көміртекті
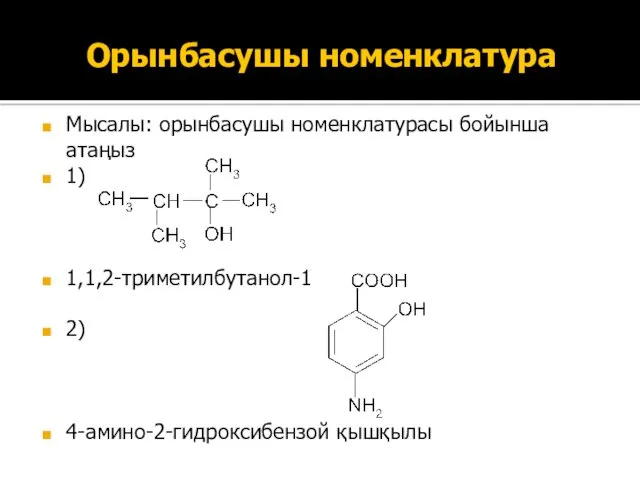
- 16. Орынбасушы номенклатура Мысалы: орынбасушы номенклатурасы бойынша атаңыз 1) 1,1,2-триметилбутанол-1 2) 4-амино-2-гидроксибензой қышқылы Мысалы: орынбасушы номенклатурасы бойынша
- 17. Осы номенклатура бойынша атаулар негізіне гомолог қатарындағы қарапайым (бірінші) өкілі алынады. Қалған қосылыстар осы қосылыстардың туындылары
- 18. Радикало-функционалды номенклатура Органикалық радикалдың атауын қосатын, қосылыстың химиялық класын анықтайтын, мінездемелік функционалды топтың аты негізгі атауына
- 19. Изомерлер Изомерлер – құрамы бірдей, бірақ атомдардың байланысу реті әртүрлі немесе кеңістіктегі орналасуы, қасиеттері әртүрлі қосылыстар.
- 20. Структуралық изомерлер Структуралық изомерлер өздерінің химиялық құрлысы яғни атомдардың арасындағы байланыстардың табиғаты немесе реті бойынша ажыратылады.
- 21. Стереоизомерлер Стереоизмерлер - молекуладағы атомдардың кеңістіктегі орналасуымен бөлектенеді. Стереохимияда негізгі екі түсінік бар: конфигурация конформацияны
- 22. Конфигурация Конфигурация – молекуладағы атомдардың кеңістікте белгілі ретпен орналасуы. Конфигурациялық изомерлерге жатады: оптикалық изомерлер (асимметриялық көміртек
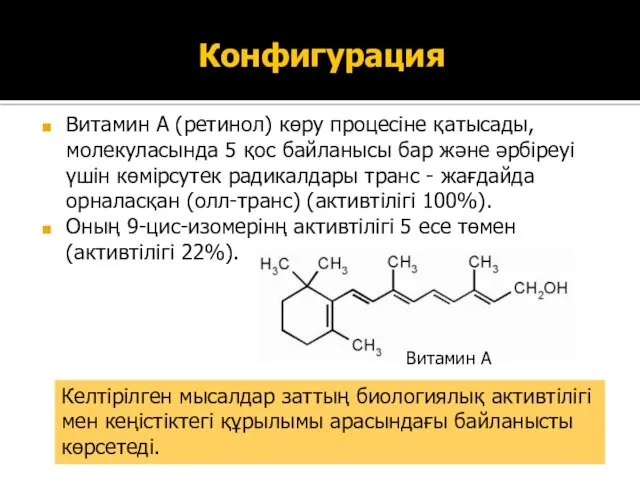
- 23. Конфигурация Витамин А (ретинол) көру процесіне қатысады, молекуласында 5 қос байланысы бар және әрбіреуі үшін көмірсутек
- 24. Конформация Конформация – деп белгілі бір конфигурациядағы молекуланың атомдарының бір немесе бірнеше σ-байланыстар айналасында бұрылу нәтижесінде
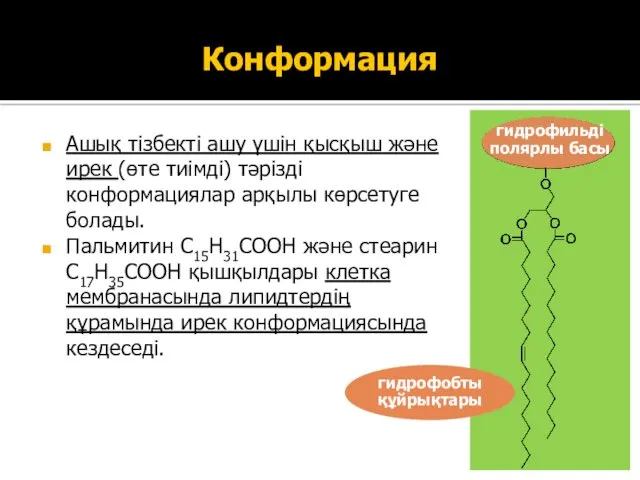
- 25. Конформация Ашық тізбекті ашу үшін қысқыш және ирек (өте тиімді) тәрізді конформациялар арқылы көрсетуге болады. Пальмитин
- 26. Электртерістілігі (ЭТ) Органикалық қосылыстардың құрамындағы элементтердің электртерістілігі, яғни атомдарды өзара байланыстыратын валенттік электрондарды тарту қабілеті әртүрлі
- 27. Электртерістірігі Америка химигі Лайнус Полинг атомдардың электртерістірігінің сандық сипаттамасын (Полинг қатары) ұсынды. Электртерістілігі әртүрлі атомдар байланысқан
- 28. Полярлануы Байланыстың полярлануы, байланыс электрондарының сыртқы электр өрісінің әсерінен ығысу мөлшері. Полярлануына қарай π - байланыс
- 29. Электрондық эффектілер Барлық молекула құратын атомдар байланыста болады және өзара бірімен әсерлесуді сезінеді. Бұл әсерлер электрондық
- 30. 1. Индуктивті эффект бұл орынбасушының әсерінен электрондар тығыздығының σ - байланыс арқылы берілуі. Индуктивті эффекттің пайда
- 31. Индуктивті эффект Индуктивті эффектіні байланыс бойынша түзу стрелкамен көрсетеді, стрелканың ұшы ЭТ жоғары атомға қарай бағытталады.
- 32. 2. Мезомерлі эффект (қабысу эффектісі) бұл орынбасушының әсерінен электрондар тығыздығының π- байланыстардың жүйесімен таралуы. Мезомерлі эффект
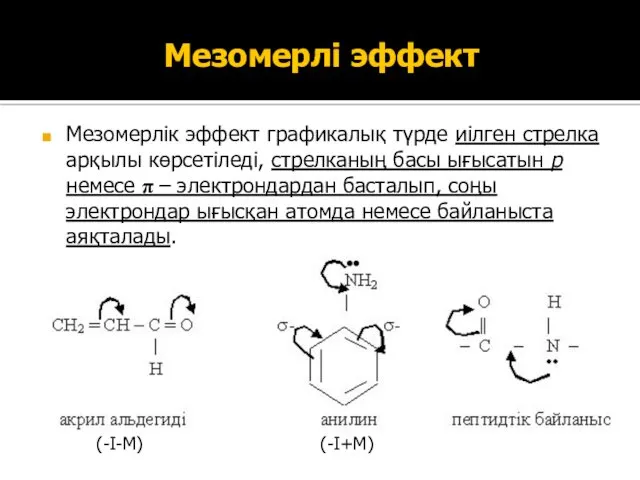
- 33. Мезомерлі эффект Мезомерлік эффект графикалық түрде иілген стрелка арқылы көрсетіледі, стрелканың басы ығысатын р немесе π
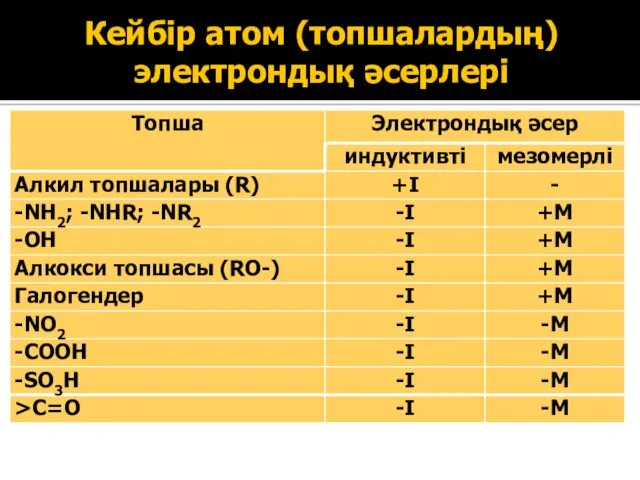
- 34. Кейбір атом (топшалардың) электрондық әсерлері
- 35. Субстрат және реагент Құрамындағы көміртек атомының жаңа байланыстың түзілуі жүретін зат молекуласы, ереже бойынша субстрат (органикалық
- 36. Органикалық реакцияның жіктелуі Органикалық реакциялар бірнеше әдіспен жіктеледі: соңғы нәтижесіне қарай және субстрат пен реагентте байланыстың
- 37. Органикалық реакцияның жіктелуі Субстрат пен реагенттегі байланыстардың сипаты бойынша жіктелуі Субстратта байланыстың үзілуіне қарап барлық химиялық
- 38. Коваленттік байланыстың ыдырауы Гомолититтік ыдырау Радикалдық реакцияларда субстратта байланыс гомолиттік болып бөлінеді және осы кезде бос
- 39. Электрофилді механизм Егер субстраттың реакциялық орталығы электрон тығыздығы жоғары болса (δ-) (электронды жақсы көреді), ал реагент
- 40. Нуклеофильді механизм Субстраттың реакциялық орталығында ішінара оң заряд (δ+) пайда болғанда, реакция нуклеофильді механизм бойынша жүреді.
- 42. Скачать презентацию































 Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Структура реального кристалла
Структура реального кристалла Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Чистые вещества и смеси
Чистые вещества и смеси Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар
Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)
Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)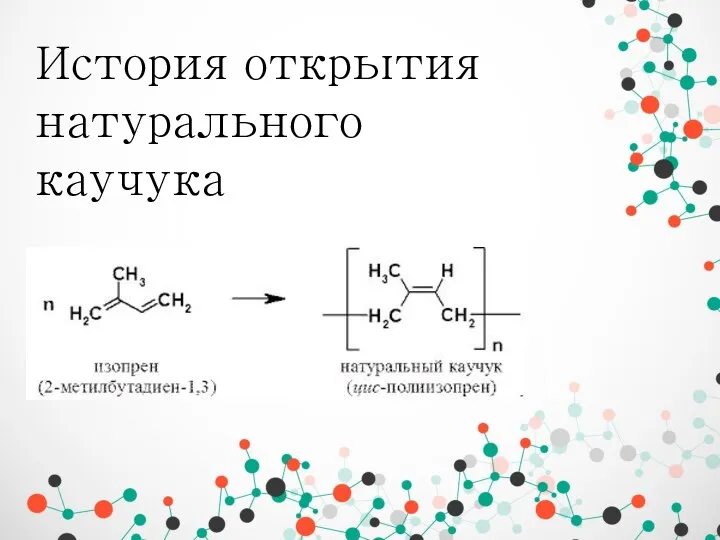 История открытия натурального каучука
История открытия натурального каучука Устойчивость дисперсных систем
Устойчивость дисперсных систем Cкорость химической реакции
Cкорость химической реакции Степень окисления
Степень окисления Выделение ферментных препаратов методами осаждения и высаливания
Выделение ферментных препаратов методами осаждения и высаливания Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Химическая связь
Химическая связь Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Галогены в Периодической системе Д.И. Менделеева
Галогены в Периодической системе Д.И. Менделеева Минералогия. Формы нахождения минералов в природе. Свойства минералов
Минералогия. Формы нахождения минералов в природе. Свойства минералов Аллотропия
Аллотропия Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation
Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем
Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе Углекислый газ
Углекислый газ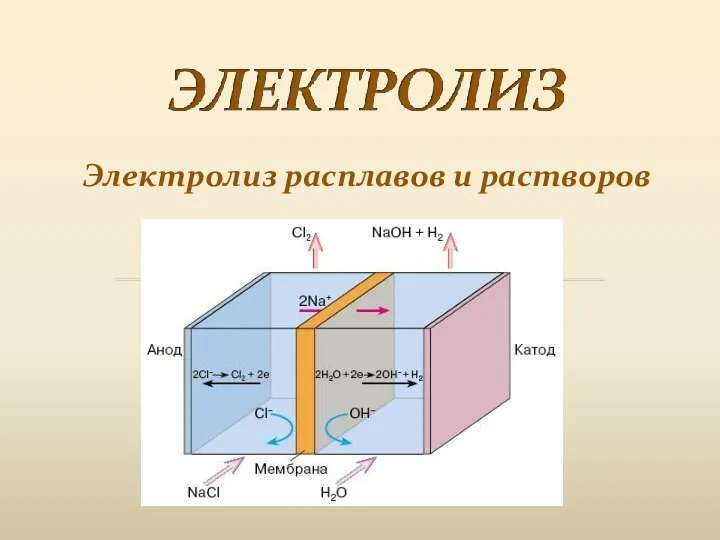 Электролиз расплавов и растворов
Электролиз расплавов и растворов Пластмассы
Пластмассы Основания. 8 класс
Основания. 8 класс