Содержание
- 2. Хімічний зв'зок і будова речовини Хімічний зв’язок: типи хімічного зв’язку, способи утворення. Теорії хімічного зв’язку: Метод
- 3. Хімічний зв’язок: типи хімічного зв’язку, способи утворення. Теорії хімічного зв’язку: Метод валентних зв’язків та метод молекулярних
- 4. При взаємодії атомів, іонів чи їх груп між ними може виникати хімічний звя'зок, який приводить до
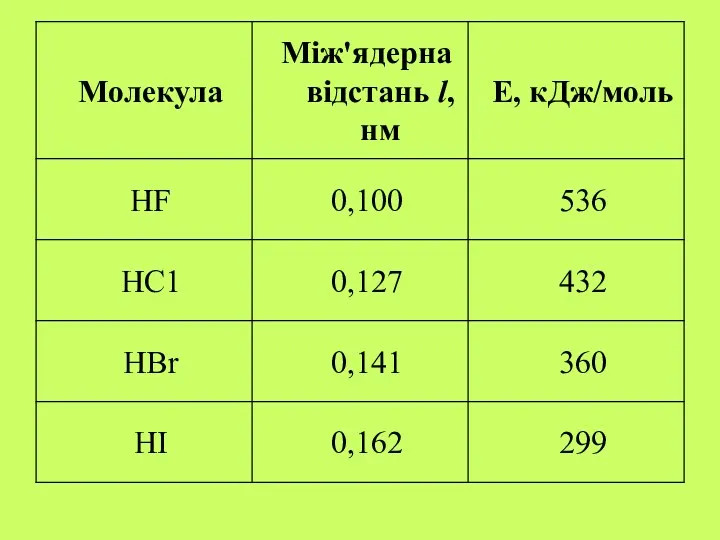
- 5. Основні параметри хімічного зв'язку довжина зв'язку l - відстань між центрами атомів у молекулі; валентні кути
- 8. Ковалентний зв'язок Хімічний зв'язок, який утворюється внаслідок узагальнення електронів взаємодіючих атомів (утворення спільної електронної пари), називають
- 9. Властивості ковалентного зв'язку 1. Насичуваність — це здатність атомів утворювати обмежену кількість ковалентних зв'язків. Внаслідок насичуваності
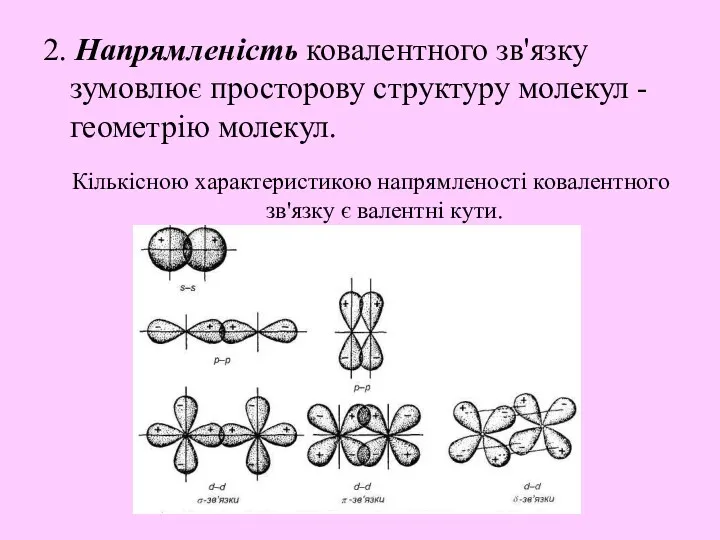
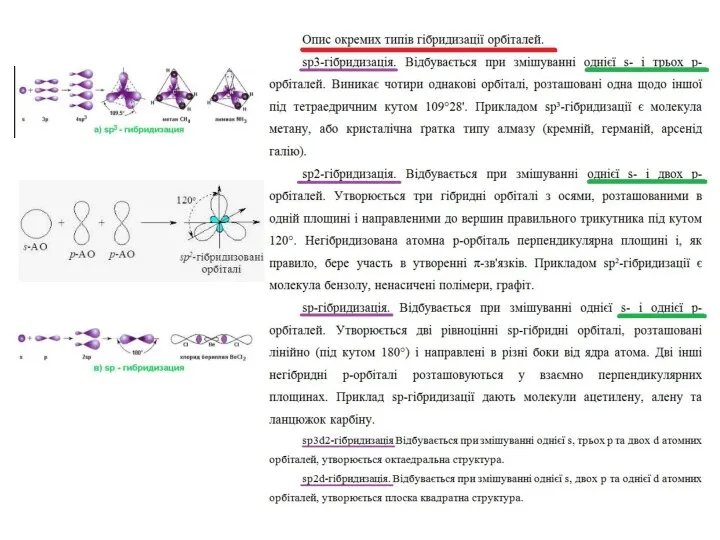
- 10. 2. Напрямленість ковалентного зв'язку зумовлює просторову структуру молекул - геометрію молекул. Кількісною характеристикою напрямленості ковалентного зв'язку
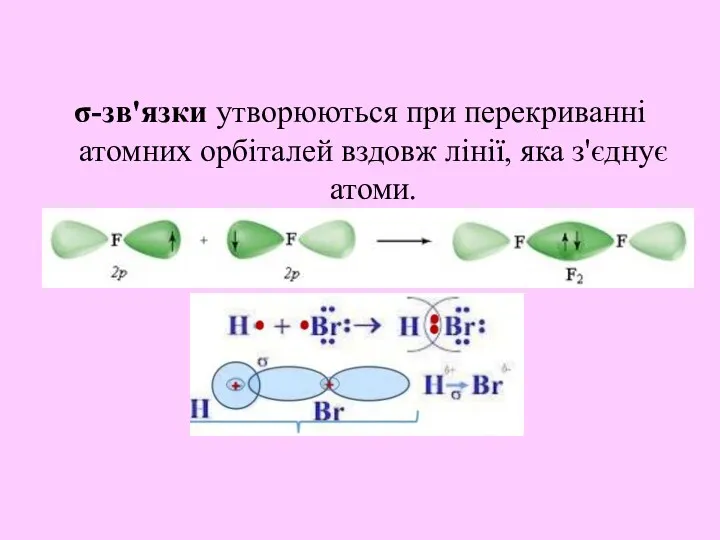
- 13. σ-зв'язки утворюються при перекриванні атомних орбіталей вздовж лінії, яка з'єднує атоми.
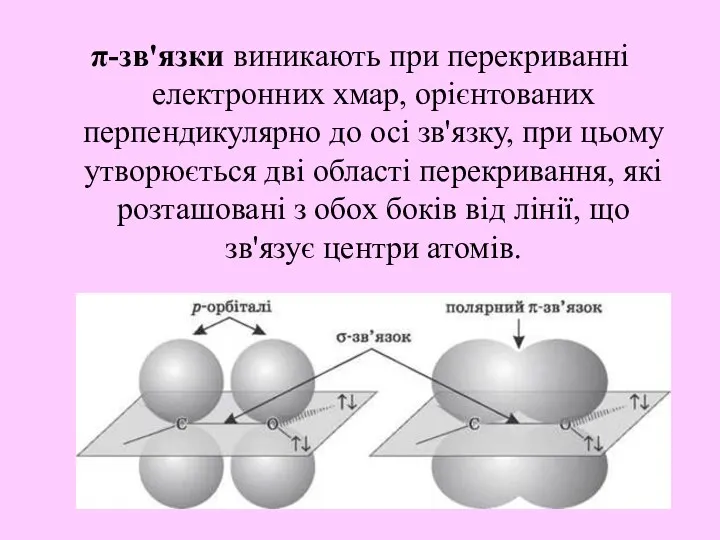
- 14. π-зв'язки виникають при перекриванні електронних хмар, орієнтованих перпендикулярно до осі зв'язку, при цьому утворюється дві області
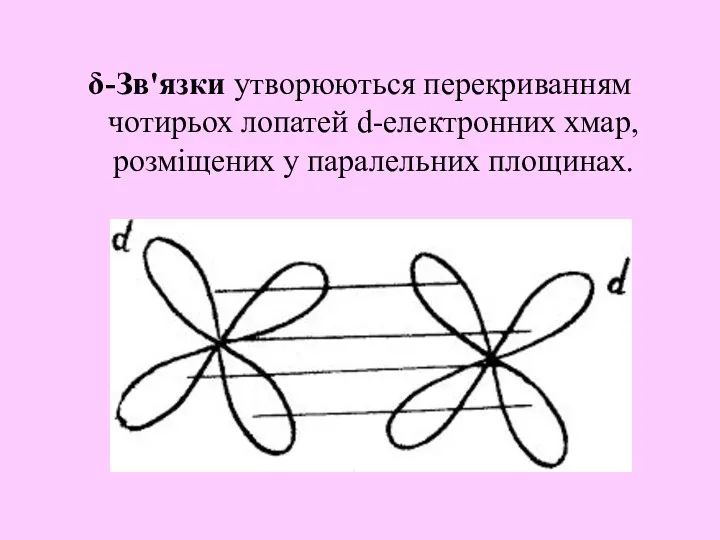
- 15. δ-Зв'язки утворюються перекриванням чотирьох лопатей d-електронних хмар, розміщених у паралельних площинах.
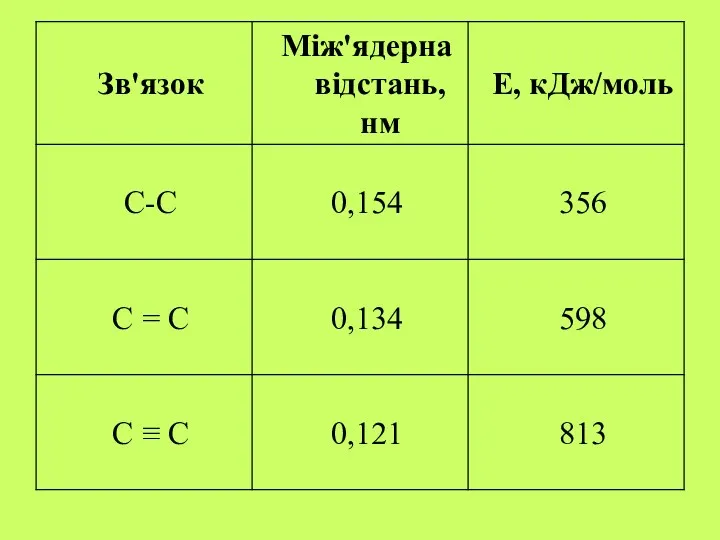
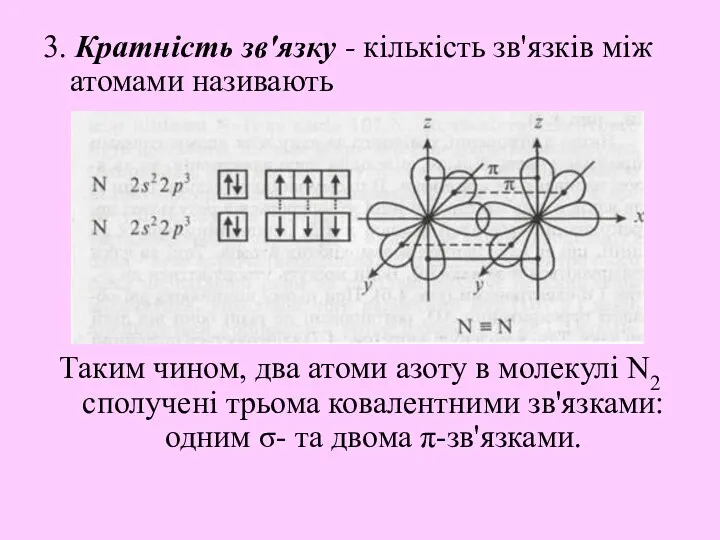
- 16. 3. Кратність зв'язку - кількість зв'язків між атомами називають Таким чином, два атоми азоту в молекулі
- 17. 4. Полярність та поляризованість зв'язку Ковалентним неполярним називають зв'язок в молекулах яких електронна хмара розташовується відносно
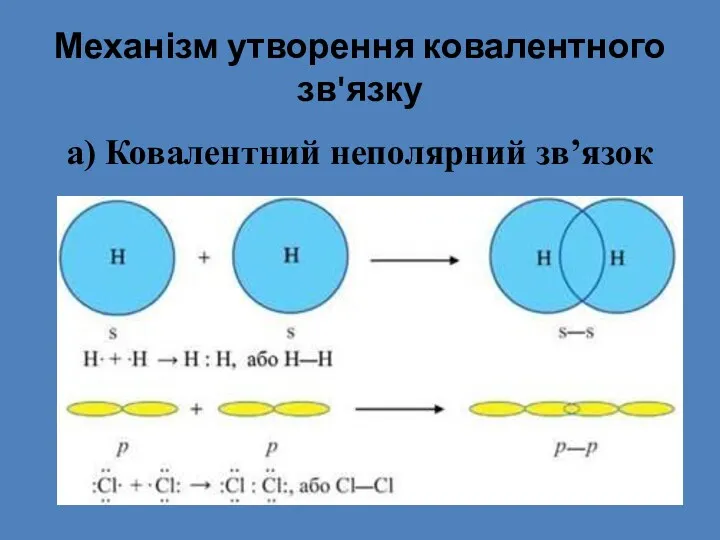
- 18. Механізм утворення ковалентного зв'язку а) Ковалентний неполярний зв’язок
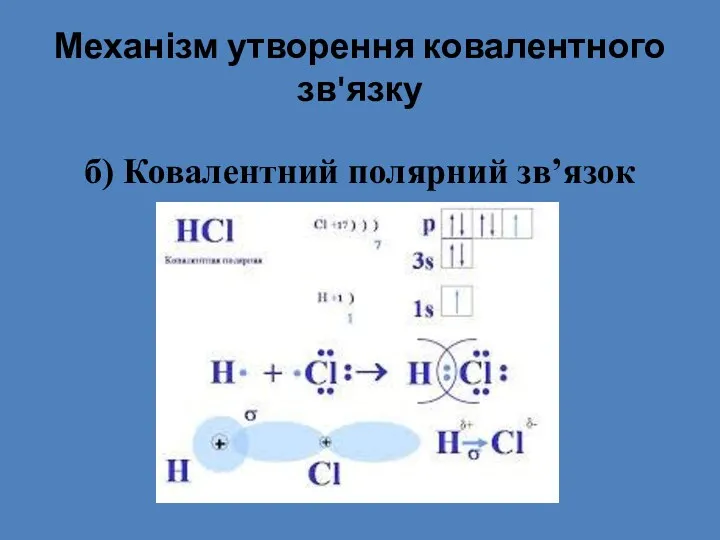
- 19. Механізм утворення ковалентного зв'язку б) Ковалентний полярний зв’язок
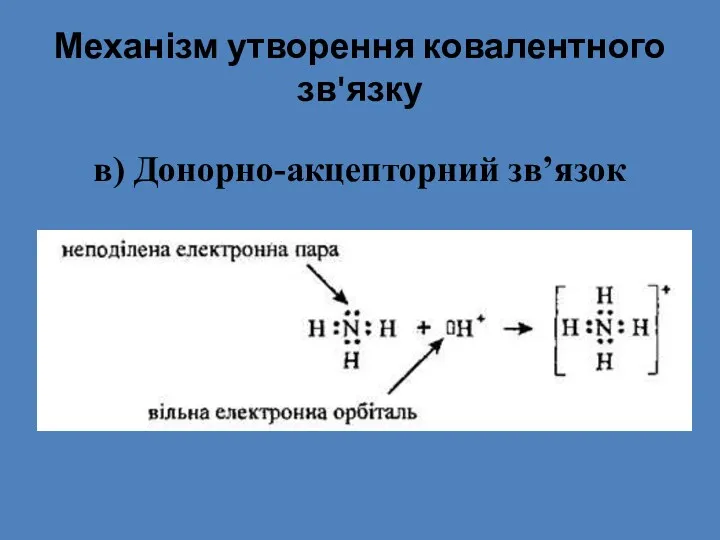
- 20. Механізм утворення ковалентного зв'язку в) Донорно-акцепторний зв’язок
- 21. Валентність — це число ковалентних зв'язків, які утворює атом даного елемента в основному або збудженому стані
- 22. Ступінь окиснення елементів Під ступенем окиснення розуміють електричний заряд атома у сполуці, який обчислюють із припущення,
- 23. Для обчислення ступеня окиснення елементів користуються такими положеннями: Ступінь окиснення елемента в його простій речовині дорівнює
- 24. Іонний зв'язок Хімічний зв'язок обумовлений електростатичною взаємодією протилежно заряджених іонів називається іонним.
- 25. Атоми натрію і хлору мають незавершені зовнішні рівні. Na 1s22s22p63s1 Cl 1s22s22p63s23p5 При взаємодії цих елементів
- 26. Не можна провести жорстку межу між іонним зв'язком і ковалентним полярним зв'язком. Можна оцінити лише ступінь
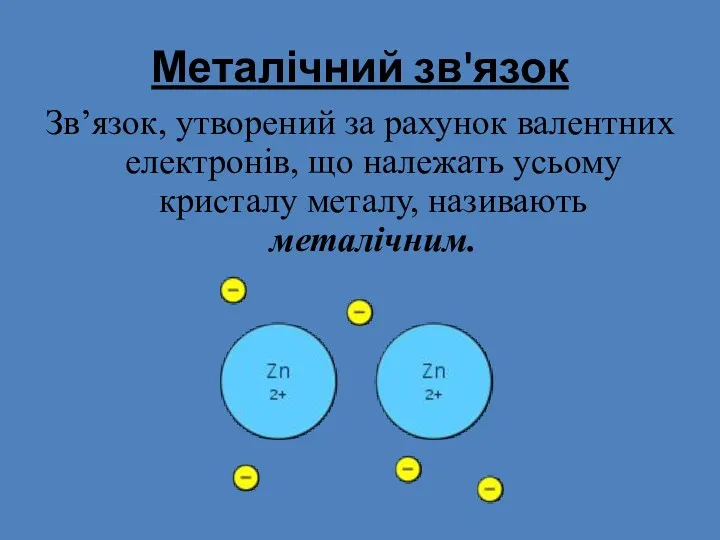
- 27. Металічний зв'язок Зв’язок, утворений за рахунок валентних електронів, що належать усьому кристалу металу, називають металічним.
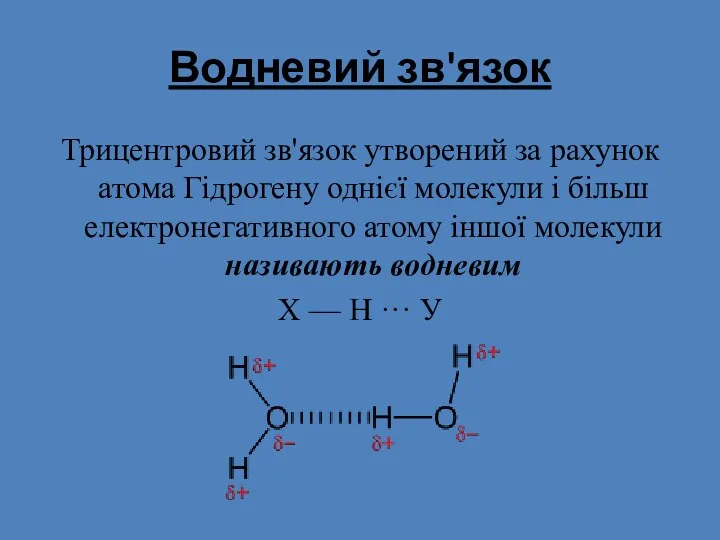
- 28. Водневий зв'язок Трицентровий зв'язок утворений за рахунок атома Гідрогену однієї молекули і більш електронегативного атому іншої
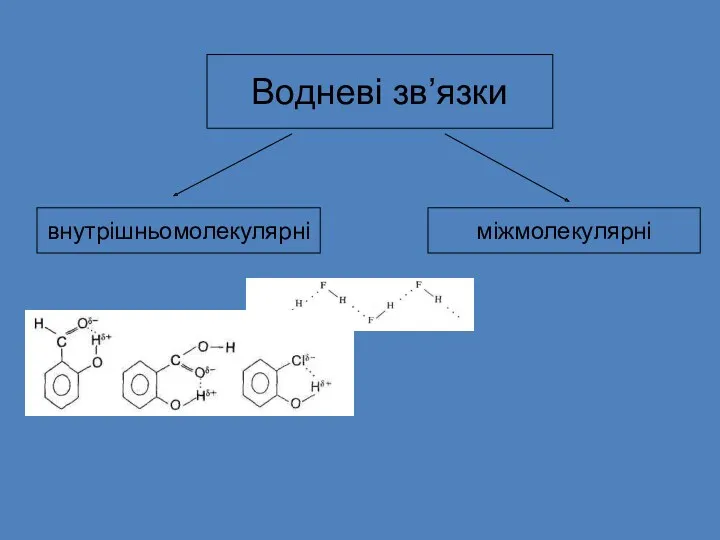
- 29. Водневі зв’язки внутрішньомолекулярні міжмолекулярні
- 31. Скачать презентацию













 Кислоты. Состав кислот
Кислоты. Состав кислот Реакції йонного обміну. Йонно-молекулярні рівняння
Реакції йонного обміну. Йонно-молекулярні рівняння Амфотерные соединения
Амфотерные соединения Гетероциклические соединения
Гетероциклические соединения Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Товары бытовой химии
Товары бытовой химии Кристаллофизика_часть_1
Кристаллофизика_часть_1 Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Химические соединения в организме человека
Химические соединения в организме человека Способы и степень дробления
Способы и степень дробления Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Химическая термодинамика
Химическая термодинамика Свойства воды. Оценка качества
Свойства воды. Оценка качества Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Химический элемент фосфор
Химический элемент фосфор Углерод и его соединения
Углерод и его соединения Характеристика металу Ферум
Характеристика металу Ферум Separation amp confirmation
Separation amp confirmation Оксиды. Физические свойства
Оксиды. Физические свойства Галогены. Нахождение в природе
Галогены. Нахождение в природе Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Биоорганическая химия
Биоорганическая химия