Содержание
- 2. Ми знаємо, що за такою ознакою, як зміна числа вихідних і кінцевих речовин всі хімічні реакції
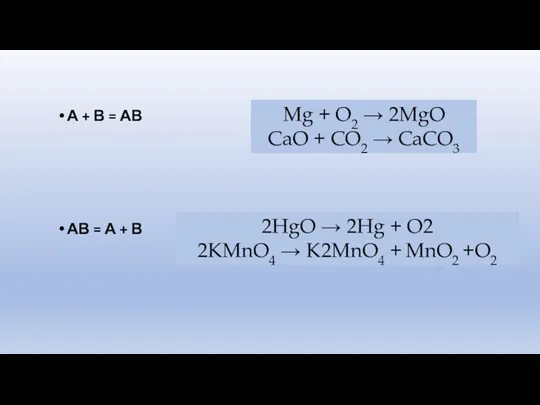
- 3. А + В = АВ АВ = А + В Mg + O2 → 2MgO CaO
- 4. А + ВС = АС + В АВ + СD = АD + СВ Zn +
- 5. Реакції обміну – це реакції між двома складними речовинами, які обмінюються своїми складовими частинами – йонами.
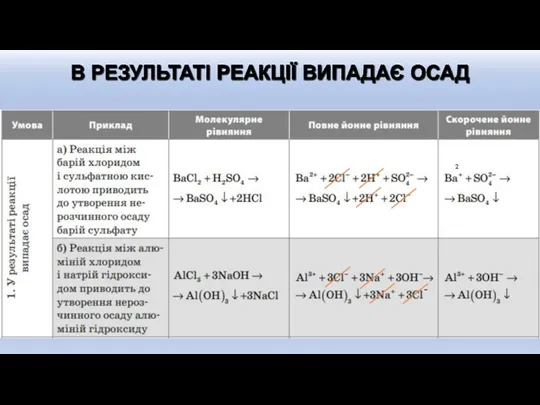
- 6. Електроліти у водних розчинах розпадаються (дисоціюють) на йони. Якщо в результаті реакції між йонами - утворюється
- 7. АЛГОРИТМ СКЛАДАННЯ ЙОННИХ РІВНЯНЬ РЕАКЦІЙ
- 8. 2 -
- 9. 2- +
- 10. Ca2+ +2OH- +2H+ + SO42- →
- 11. На основі скороченого йонного рівняння можно скласти повне йонне рівняння і молекулярне рівняння. Наприклад: Скорочене йонне
- 12. Розв’язування вправ
- 13. 4. Складіть молекулярні рівняння реакцій, що відповідають таким йонно-молекуляним рівнянням: 5. Складіть йонно-молекулярні рівняння таких реакцій:
- 14. 7. Наведіть приклад розчинної у воді солі, під час взаємодії якої як з калій сульфатом, так
- 16. Скачать презентацию











 Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Фазовое равновесие
Фазовое равновесие Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Хром. Физические свойства и применение
Хром. Физические свойства и применение Валентность и степень окисления
Валентность и степень окисления Минералы и горные породы
Минералы и горные породы Алюминий и его соединения
Алюминий и его соединения Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Спирты
Спирты Оксиды углерода
Оксиды углерода Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация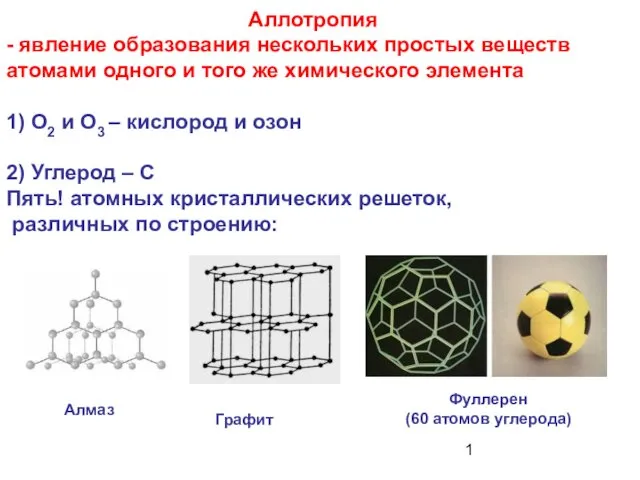 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Соли. 11 класс
Соли. 11 класс Аминокислоты
Аминокислоты Органические и неорганические кислоты
Органические и неорганические кислоты Отложения и коррозия
Отложения и коррозия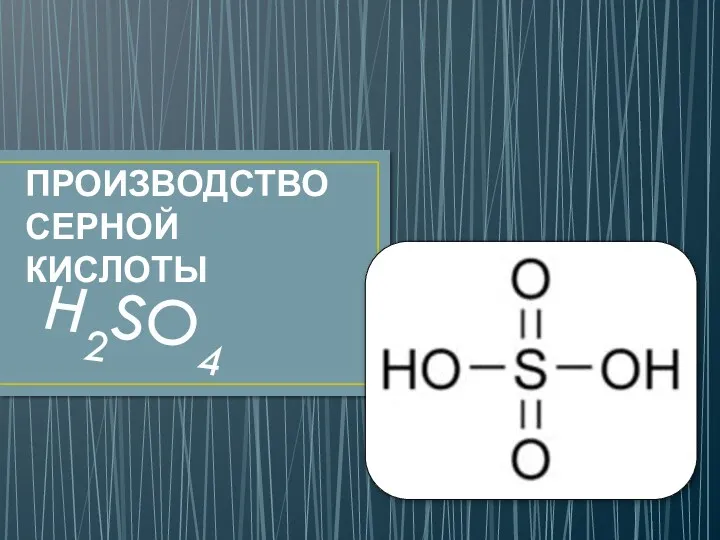 Производство серной кислоты
Производство серной кислоты Метод молекулярных орбиталей
Метод молекулярных орбиталей Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Кисень та хімічні властивості кисню. 7 клас
Кисень та хімічні властивості кисню. 7 клас Химические свойства воды
Химические свойства воды Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Сера
Сера Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ