Содержание
- 2. Понятие Агрегатного состояния вещества: физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления. Изменение агрегатного
- 3. Традиционно выделяют три агрегатных состояния:
- 4. Твёрдое тело: В твёрдом состоянии вещество сохраняет как форму, так и объём. При низких температурах все
- 5. Жидкость: В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это означает, что жидкость может
- 6. Газ: Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Причем заполняет весь
- 7. Плазма: Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или полностью ионизированным газом и
- 8. Понятие химической связи: Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической
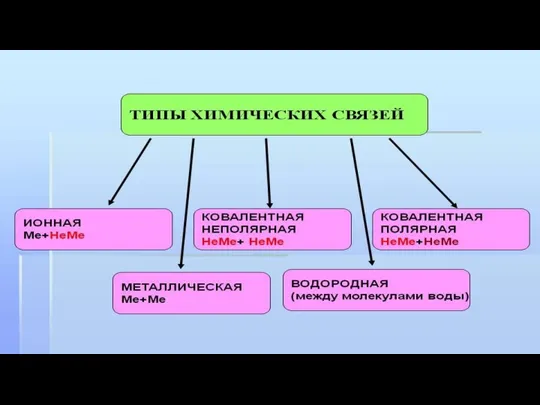
- 9. Типы химических связей
- 10. Ионная химическая связь Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные
- 11. Водородная химическая связь Еще задолго до появления современной теории химических связей в ее современном виде учеными
- 12. Химическая связь металлов Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип
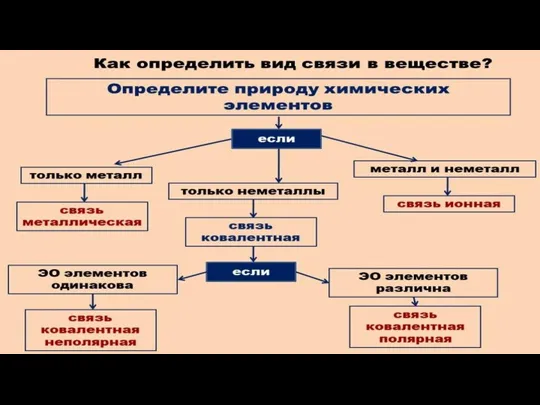
- 13. как определить вид химической связи
- 14. Свойства химических связей ◘ длина; ◘ энергия; ◘ полярность; ◘ порядок связей. ◘Длина связи – равновесное
- 16. Скачать презентацию
Понятие Агрегатного состояния вещества:
физическое состояние вещества, зависящее от соответствующего сочетания температуры
Понятие Агрегатного состояния вещества:
физическое состояние вещества, зависящее от соответствующего сочетания температуры
Традиционно выделяют три агрегатных состояния:
Традиционно выделяют три агрегатных состояния:
Твёрдое тело:
В твёрдом состоянии вещество сохраняет как форму, так и объём.
Твёрдое тело:
В твёрдом состоянии вещество сохраняет как форму, так и объём.
Жидкость:
В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это
Жидкость:
В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это
Газ:
Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни
Газ:
Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни
Плазма:
Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или
Плазма:
Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или
Плазма — самое распространённое во Вселенной агрегатное состояние вещества. В этом состоянии находится вещество звёзд и вещество, наполняющее межпланетное, межзвёздное и межгалактическое пространство. Бо́льшая часть барионного вещества (по массе около 99,9 %) во Вселенной находится в состоянии плазмы
Понятие химической связи:
Под химической связью в химии понимается взаимное сцепление
Понятие химической связи:
Под химической связью в химии понимается взаимное сцепление
Типы химических связей
Типы химических связей
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении
Водородная химическая связь
Еще задолго до появления современной теории химических связей в
Водородная химическая связь
Еще задолго до появления современной теории химических связей в
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ
как определить вид химической связи
как определить вид химической связи
Свойства химических связей
◘ длина;
◘ энергия;
◘ полярность;
◘ порядок связей.
◘Длина связи –
Свойства химических связей
◘ длина;
◘ энергия;
◘ полярность;
◘ порядок связей.
◘Длина связи –
◘Энергия химической связи определяет ее прочность.
◘полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов.
◘Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь.











 Типы химических реакций
Типы химических реакций Закон сохранения массы веществ
Закон сохранения массы веществ Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Кристаллические решетки
Кристаллические решетки Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Моющие средства
Моющие средства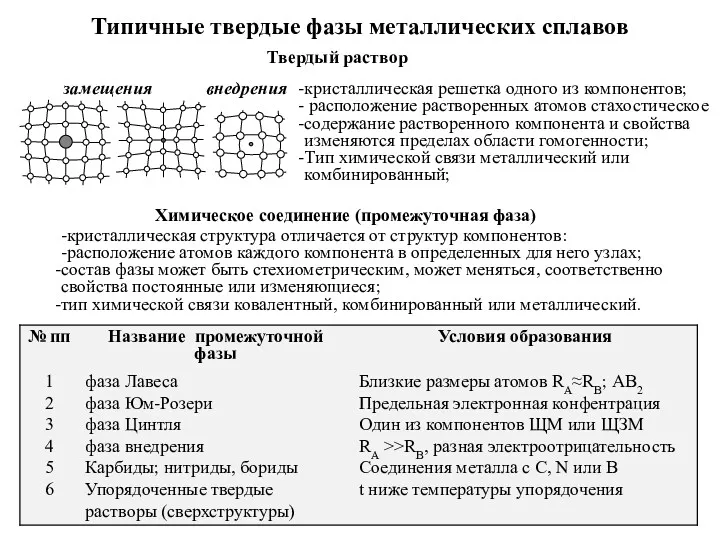 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Гигиена питания школьников
Гигиена питания школьников Классификация химических реакций
Классификация химических реакций Геохимия литосферы
Геохимия литосферы Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Гидролиз солей
Гидролиз солей Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Роль химии в создании новых материалов
Роль химии в создании новых материалов