Содержание
- 2. Инструкция по работе с презентацией В рабочей тетради на развороте (две страницы) нарисуйте таблицу, состоящую из
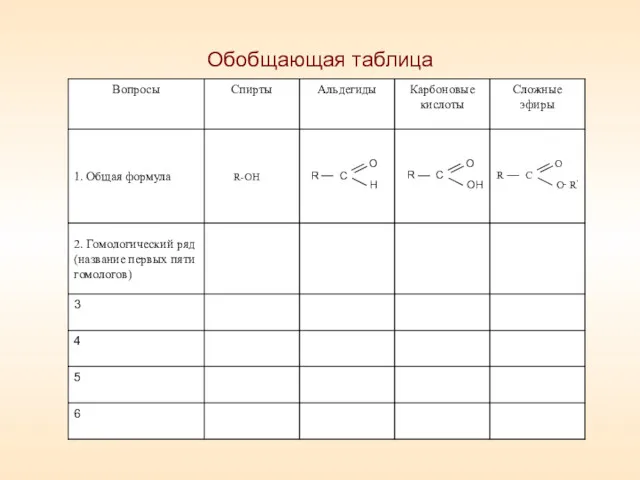
- 3. Обобщающая таблица
- 4. Спирты Метанол Этанол Пропанол Бутанол Пентанол Альдегиды Метаналь Этаналь Пропаналь Бутаналь Пентаналь
- 5. Карбоновые кислоты Метановая (муравьиная) Этановая (уксусная) Пропановая (пропионовая) Бутановая (масляная) Пентановая (валериановая)
- 6. Сложные эфиры Метиловый эфир муравьиной кислоты (метилформиат) Метиловый эфир уксусной кислоты (метилацетат) Метиловый эфир пропионовой кислоты
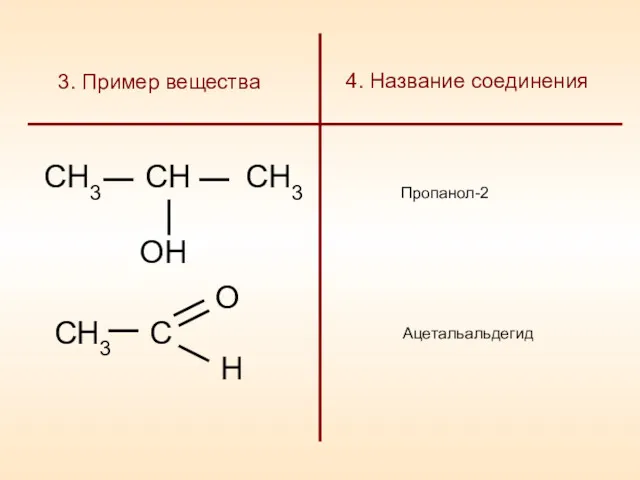
- 7. 3. Пример вещества Пропанол-2 Ацетальальдегид 4. Название соединения
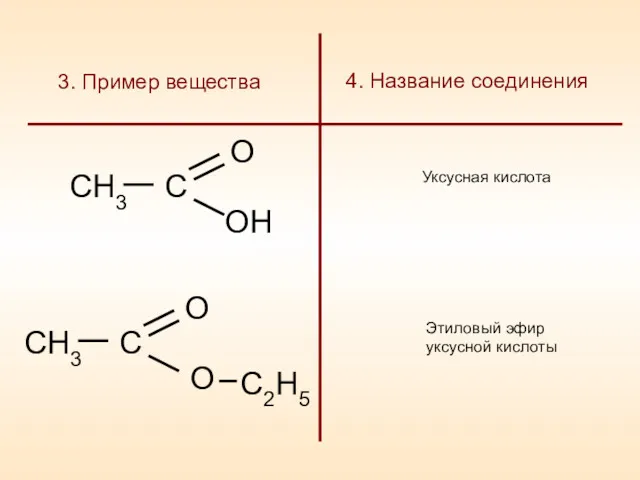
- 8. СН3 С О ОН Уксусная кислота Этиловый эфир уксусной кислоты 4. Название соединения 3. Пример вещества
- 9. 5. Виды структурной изомерии, характерные для данного класса Спирты: Изомерия углеродного скелета Изомерия положения гидроксильной группы
- 10. Альдегиды: Изомерия углеродного скелета Межклассовая изомерия с кетонами 5. Виды структурной изомерии, характерные для данного класса
- 11. Карбоновые кислоты : Изомерия углеродного скелета Межклассовая изомерия со сложными эфирами 5. Виды структурной изомерии, характерные
- 12. Сложные эфиры : изомерия углеродного скелета; изомерия положения группы; межклассовая изомерия с карбоновыми кислотами. 5. Виды
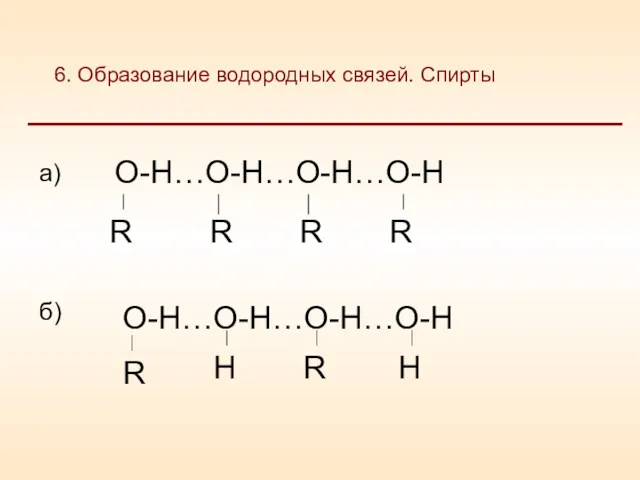
- 13. а) между молекулами вещества; б) между молекулами воды и молекулами вещества. 6. Образование водородных связей
- 14. 6. Образование водородных связей. Спирты а) б)
- 15. а) Невозможно образование водородных связей между молекулами альдегидов б) 6. Образование водородных связей. Альдегиды
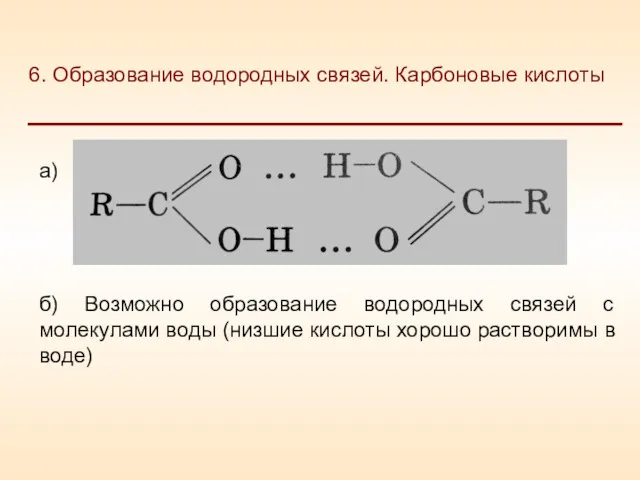
- 16. а) б) Возможно образование водородных связей с молекулами воды (низшие кислоты хорошо растворимы в воде) 6.
- 17. а) невозможно образование водородных связей между молекулами б) возможно образование водородных связей между молекулами воды и
- 18. Подготовиться к практической работе «Качественные реакции органических веществ» Повторить из §4 -13 качественные реакции. Записать в
- 19. Домашнее задание (после практической работы) Составить уравнения реакций, характеризующих свойства кислородсодержащих органических веществ (смотри инструкцию на
- 20. Инструкция по работе с презентацией . Используя схемы со слайдов 21-27 (данные схемы есть в конце
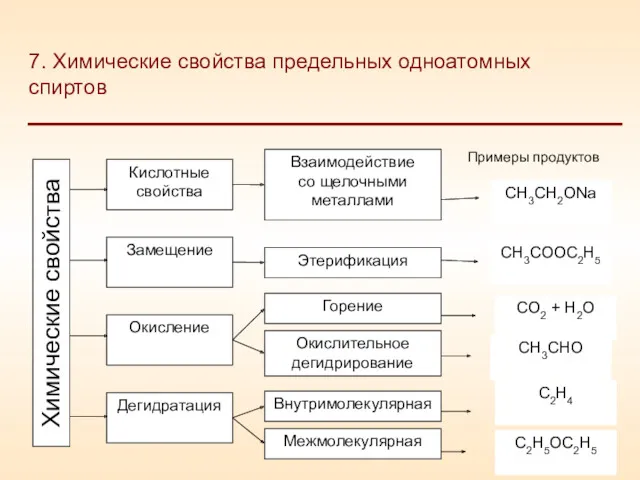
- 21. 7. Химические свойства предельных одноатомных спиртов Кислотные свойства Замещение Окисление Дегидратация Взаимодействие со щелочными металлами Этерификация
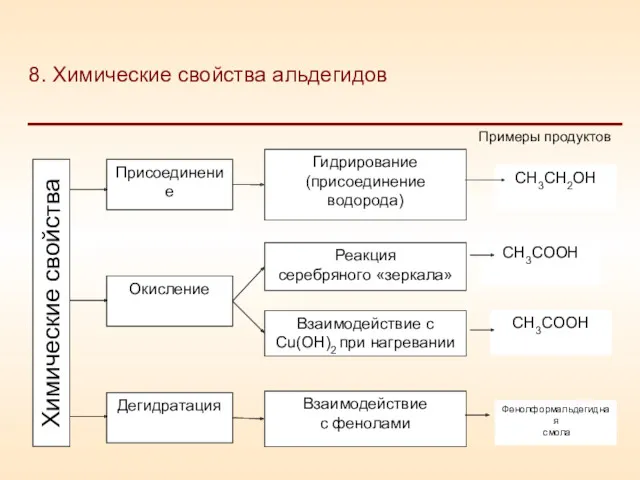
- 22. 8. Химические свойства альдегидов Присоединение Окисление Дегидратация Гидрирование (присоединение водорода) Реакция серебряного «зеркала» Взаимодействие с Cu(OH)2
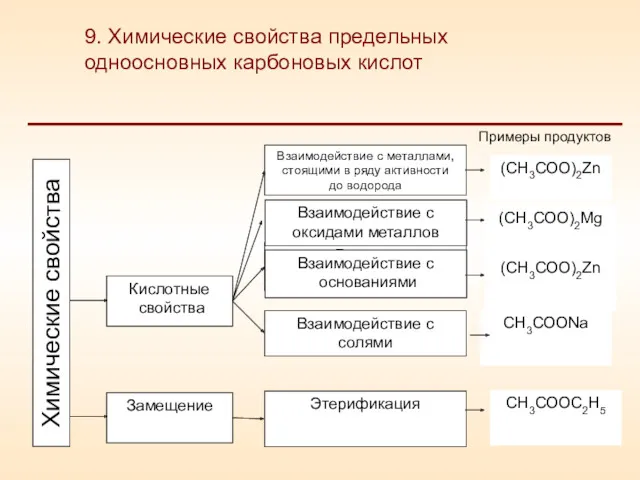
- 23. Кислотные свойства Замещение Взаимодействие с металлами, стоящими в ряду активности до водорода Реакция серебряного «зеркала» Взаимодействие
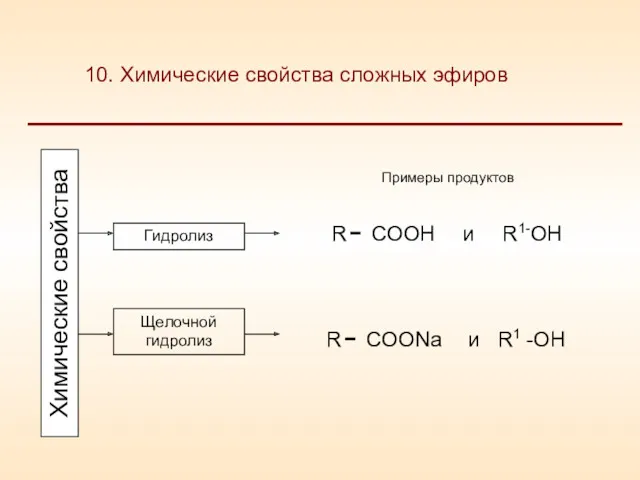
- 24. Гидролиз Щелочной гидролиз R COOH R1-OH и R COONa R1 -OH и Химические свойства 10. Химические
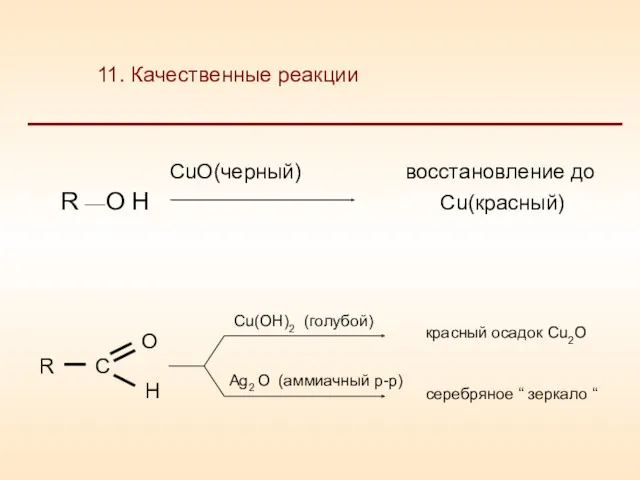
- 25. CuO(черный) восcтановление до R O H Сu(красный) 11. Качественные реакции
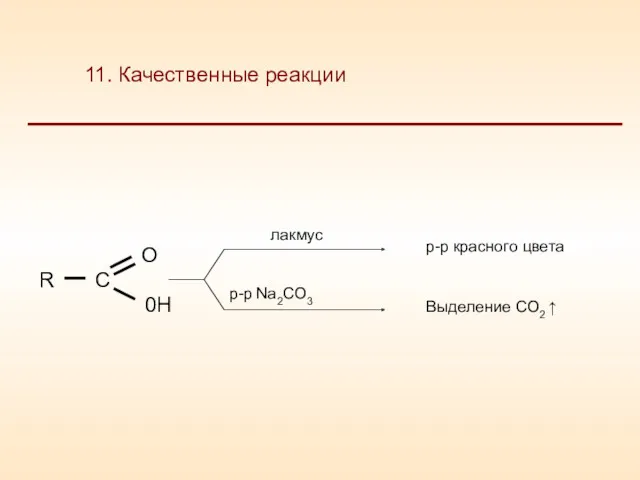
- 26. 11. Качественные реакции
- 27. Алкан → алкен → спирт → альдегид → → карбоновая кислота → сложный эфир 11. Генетическая
- 29. Скачать презентацию















 Автомобильные бензины
Автомобильные бензины Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Щелочные металлы
Щелочные металлы Химические свойства серной кислоты
Химические свойства серной кислоты Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Природный каучук
Природный каучук История открытия химических веществ
История открытия химических веществ Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Аурум
Аурум Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Алкены
Алкены Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Сероводород. Сульфиды
Сероводород. Сульфиды Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Получение и приминение этилена
Получение и приминение этилена Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Сероводород. Сульфиды
Сероводород. Сульфиды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Разнообразие неметаллов
Разнообразие неметаллов Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие