Содержание
- 2. Равновесия в окислительно-восстановительных реакциях Окислительно-восстановительные реакции – реакции, протекающие с передачей электронов и сопровождающиеся изменением степеней
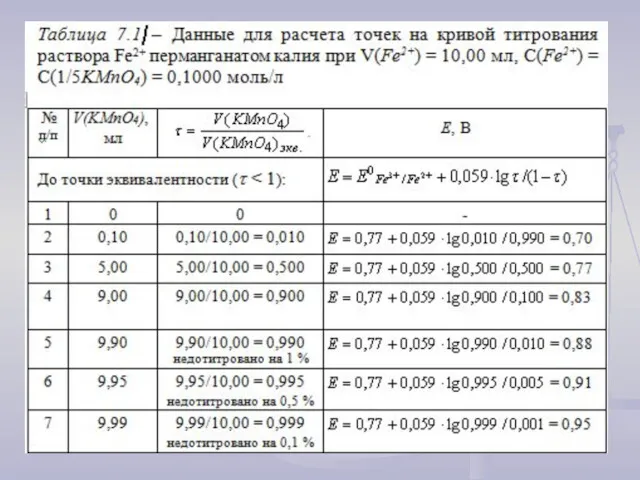
- 3. Количественной характеристикой окислительно-восстановительных свойств каждой ОВ-пары является величина стандартного (нормального) окислительно-восстановительного потенциала – Е0 Табл. 7.1
- 4. При сравнении свойств двух ОВ-пар следует помнить, что чем выше стандартный редокс-потенциал (Е0), тем сильнее проявляются
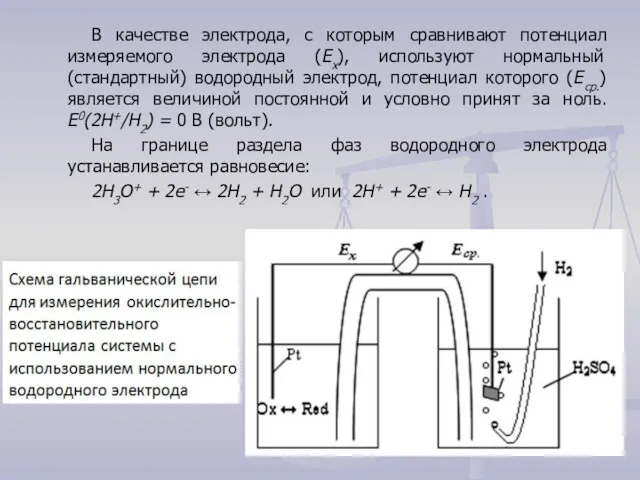
- 5. В качестве электрода, с которым сравнивают потенциал измеряемого электрода (Ех), используют нормальный (стандартный) водородный электрод, потенциал
- 6. Формальный окислительно-восстановительный потенциал системы зависит от стандартного потенциала, соотношения концентраций окисленной и восстановленной форм вещества и
- 7. На величину формального окислительно-восстановительного потенциала могут оказывать влияние также кислотность среды (рН раствора) и присутствие в
- 8. Влияние веществ – осадителей на окислительно-восстановительный потенциал системы можно проиллюстрировать на примере пары Cu2+/Cu+, формальный потенциал
- 9. После подстановки уравнения 4 в уравнение 3 получим: Для расчетов принимаем [Cu2+] = [I-]= 0,1 моль/л;
- 10. Направление протекания окислительно-восстановительных реакций Рассмотрим ОВР, протекающую по схеме: Кр z2Ох1 + z1Red2 ↔ z2Red1 +
- 11. При установлении равновесия Е1 = Е2 : = откуда (n – НОК чисел z1 и z2)
- 12. Уравнение (5) позволяет определить направление протекания ОВР: 1) если > 0, то Кр > 1, т.е.
- 13. Применение окислительно-восстановительных реакций в титриметрии В методах окислительно-восстановительного титрования (ОВТ) в качестве титрантов используются растворы сильных
- 14. Кривые титрования: построение и анализ Пусть в основе ОВТ лежит химическая реакция: z2Ох1 + z1Red2 →
- 15. 1) При τ 2) При τ = 1 (точка эквивалентности) потенциалы одной и второй ОВ-пар должны
- 16. 3) При τ > 1 (после точки эквивалентности): Red2 полностью оттитрован. В растворе присутствует избыток добавленного
- 17. Рассмотрим построение кривой ОВТ на примере титрования соли железа (II) раствором перманганата калия . Реакция протекает
- 19. Продолжение табл. 7.1
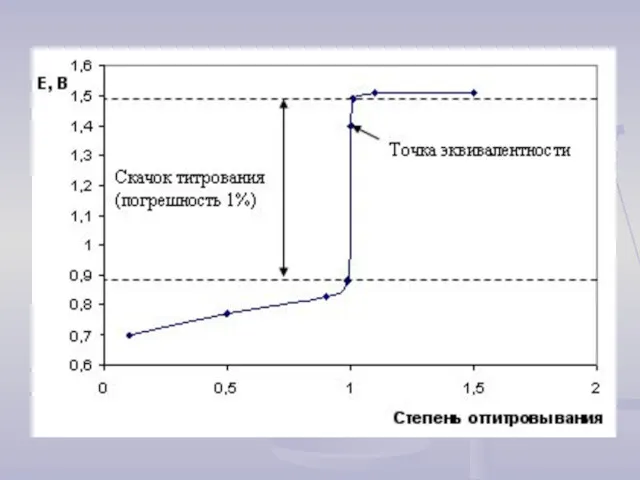
- 21. Скачок на кривой ОВТ будет заметным, если разность потенциалов превышает некоторого критического значения, которое можно оценить.
- 22. Если задана погрешность определения, равная 0,1%, (скачок титрования находится в пределах τ = 0,999 и τ
- 23. Нахождение точки эквивалентности при окислительно-восстановительном титровании 1. Безиндикаторный метод используется в том случае, когда титрант имеет
- 25. Скачать презентацию



















 Полиметилметакрилат
Полиметилметакрилат Корунд. Разновидности корунда
Корунд. Разновидности корунда Введение в химическую термодинамику
Введение в химическую термодинамику Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Шкала рН. Лекция 03-1
Шкала рН. Лекция 03-1 Реакции SR в ряду алканов
Реакции SR в ряду алканов Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция
Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция Розчин і його компоненти
Розчин і його компоненти Химические элементы и организм человека
Химические элементы и организм человека Составление формул химических соединений
Составление формул химических соединений Основні класи неорганічних сполук
Основні класи неорганічних сполук Полимеры. Основные понятия
Полимеры. Основные понятия Механизм реакции в органической химии
Механизм реакции в органической химии Водородная связь
Водородная связь Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Губна помада та ії призначення
Губна помада та ії призначення Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов Способи очищення води
Способи очищення води Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Моноядерні арени
Моноядерні арени Силіцій
Силіцій Водород
Водород Непредельные углеводороды. Алкены. Номенклатура алкенов
Непредельные углеводороды. Алкены. Номенклатура алкенов