Содержание
- 2. С водой необратимо реагируют ………… Распределите перечисленные оксиды по их кислотно-основным свойствам: NO2; Na2O; ZnO; Cr2O3;
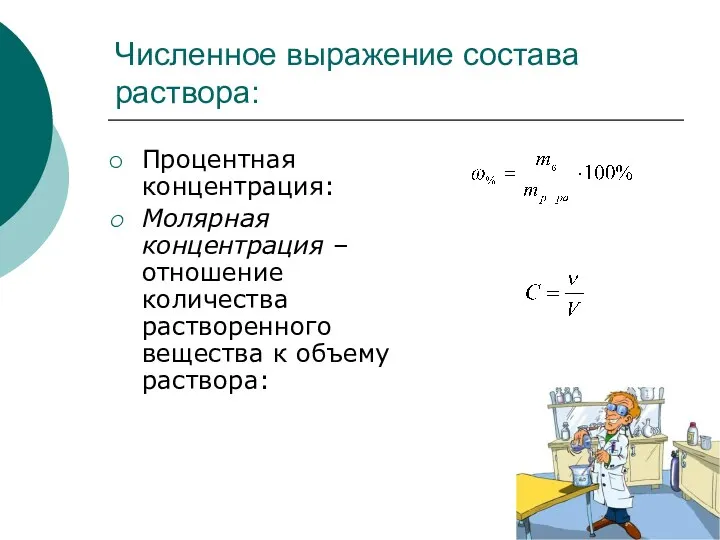
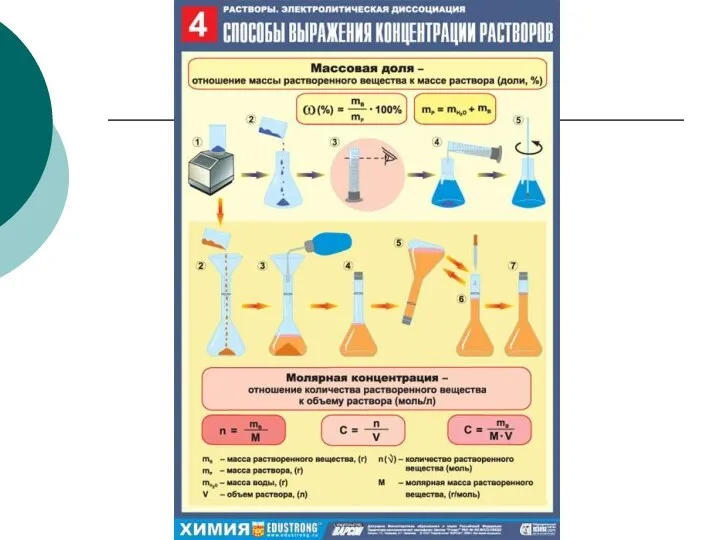
- 3. Численное выражение состава раствора: Процентная концентрация: Молярная концентрация – отношение количества растворенного вещества к объему раствора:
- 5. Задача. На нейтрализацию 10 мл раствора гидроксида натрия израсходовали 6 мл 0,5М раствора соляной кислоты. Вычислите
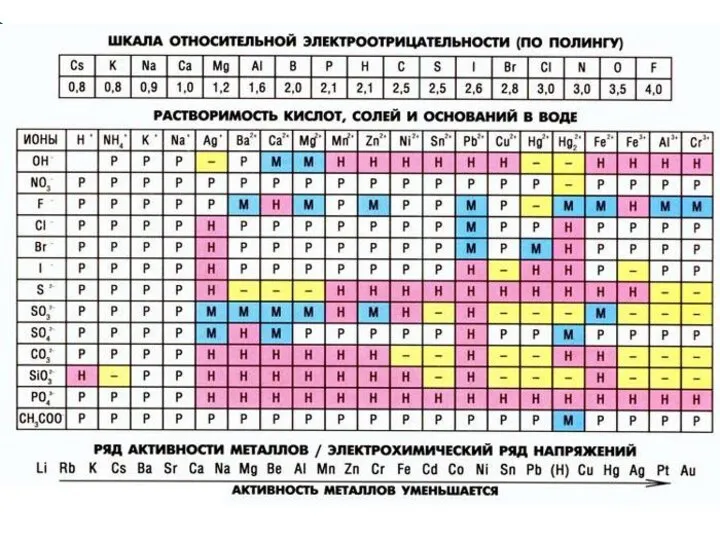
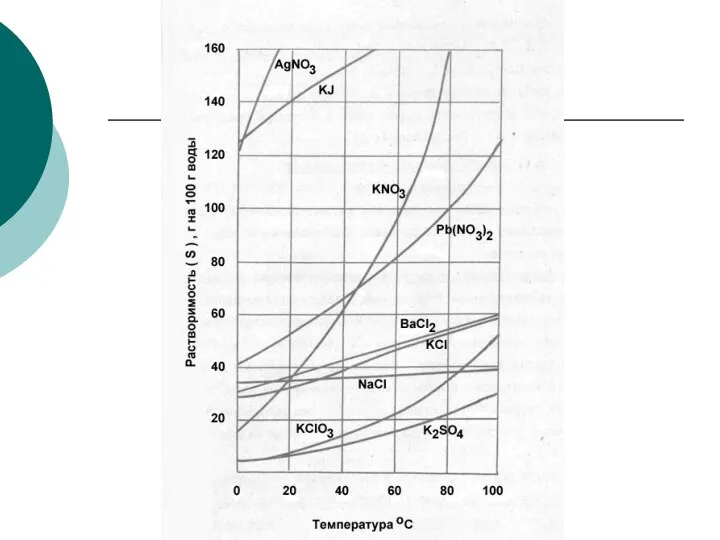
- 6. Растворимость – это свойство вещества растворяться в воде или в другом растворителе. По растворимости в воде
- 7. Подобное растворяется в подобном
- 11. В зависимости от того, проводит ли раствор электрический ток или нет, они подразделяются: Электролиты – вещества,
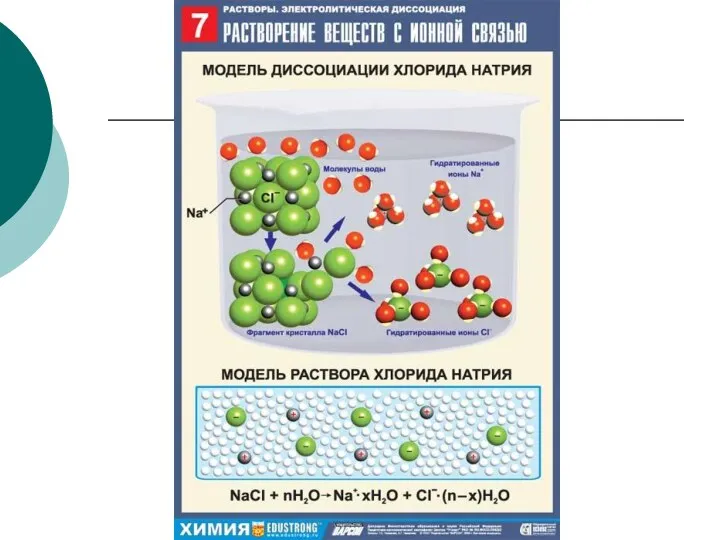
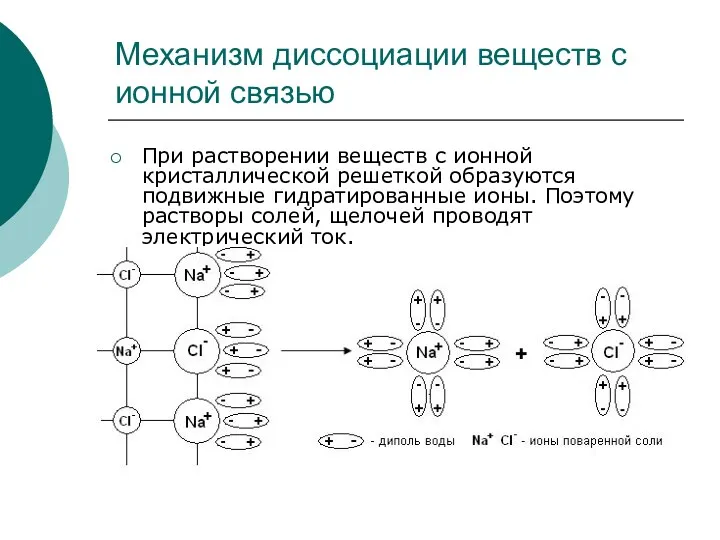
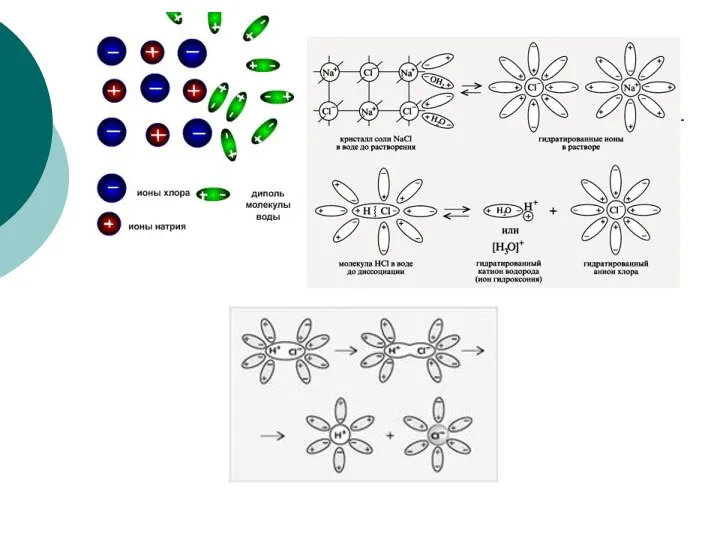
- 13. Механизм диссоциации веществ с ионной связью При растворении веществ с ионной кристаллической решеткой образуются подвижные гидратированные
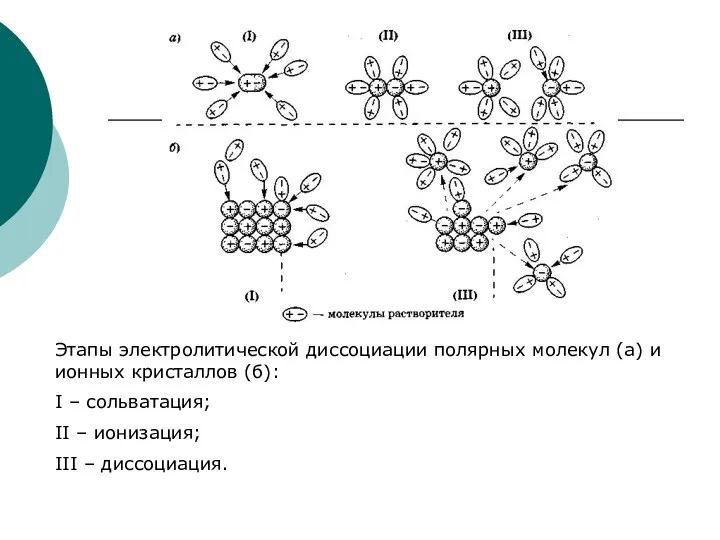
- 14. Этапы электролитической диссоциации полярных молекул (а) и ионных кристаллов (б): I – сольватация; II – ионизация;
- 16. Теория электролитической диссоциации (ТЭД) (С. А. Аррениус) Электролиты при растворении в воде распадаются (диссоциируют) на ионы:
- 18. Необходимо отметить! Ионы, в отличие от атомов, имеют завершенные внешние орбиты и отличаются своей инертностью, т.
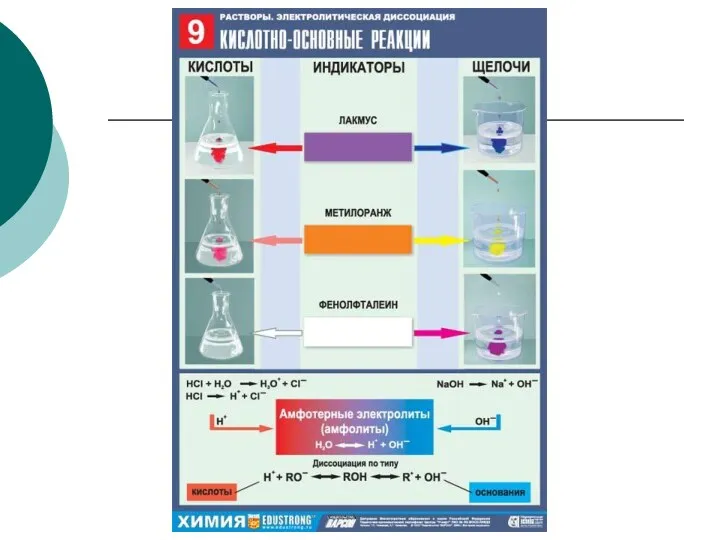
- 20. Определения с позиции ТЭД Кислоты – электролиты, которые диссоциируют на катион водорода и анион кислотного остатка
- 21. Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. a -
- 23. Электролиты по степени диссоциации делятся на сильные, средние и слабые: Сильные электролиты в воде диссоциируют на
- 24. Диссоциацию растворов можно зафиксировать количественно, причем это будет постоянная для каждого вещества: Константа диссоциации – сильные
- 25. Закон разведения Освальда (для слабых электролитов): «Степень диссоциации слабых электролитов прямопропорциональна константе диссоциации и обратнопропорциональна концентрации»
- 26. Тогда: или Для слабых электролитов известно, что a или, подставив, получим или, по Закону, получается, что:
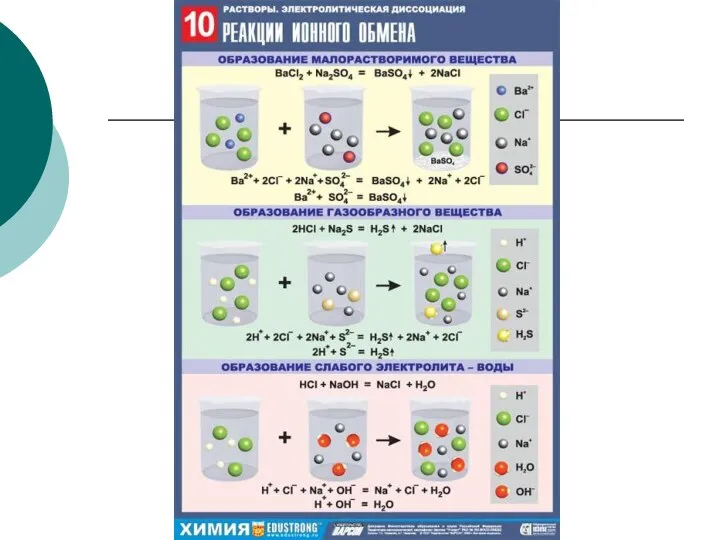
- 27. Реакции ионного обмена Реакции ионного обмена – это реакции, протекающие между ионами электролитов, образовавшихся при диссоциации.
- 32. Вода – слабый электролит. В чистой воде существует равновесие: Образование катиона или определяет принадлежность воды к
- 33. Водородный показатель pH – отрицательный десятичный логарифм концентрации ионов водорода. или Чем меньше pH, тем больше
- 36. Скачать презентацию


















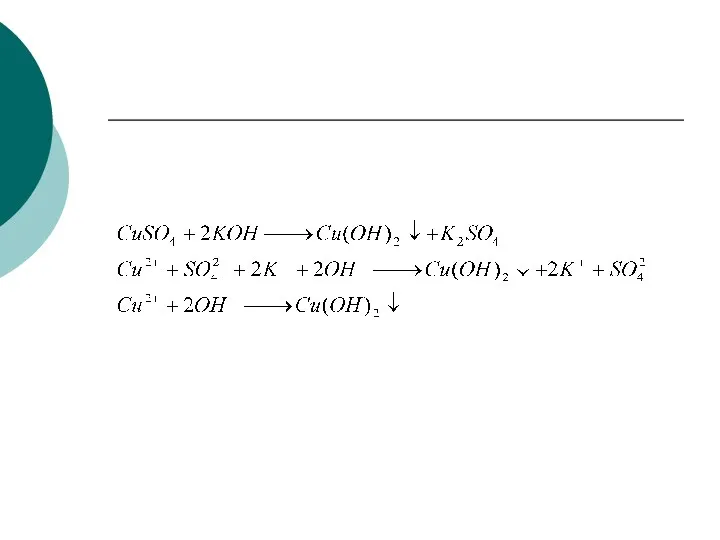

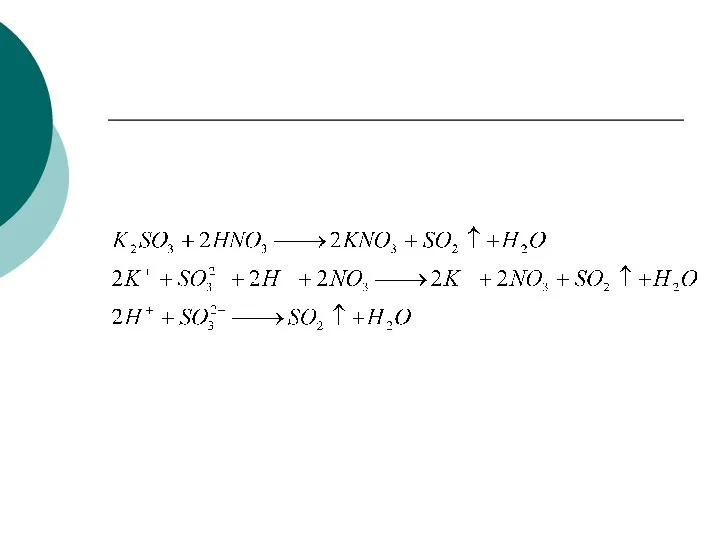


 Золото (Au). Загальна характеристика
Золото (Au). Загальна характеристика Карбоновые кислоты
Карбоновые кислоты Гетероциклические соединения
Гетероциклические соединения Двойной электрический слой, его строение. Электродный потенциал
Двойной электрический слой, его строение. Электродный потенциал Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислородсодержащие соединения серы SO2
Кислородсодержащие соединения серы SO2 Особо чистые вещества. Занятие 14
Особо чистые вещества. Занятие 14 Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Бром
Бром Резина. Состав и применение резины
Резина. Состав и применение резины Установка пиролиза широкой фракции, легких углеводородов
Установка пиролиза широкой фракции, легких углеводородов Амфотерные оксиды и гидроксиды. 8 класс
Амфотерные оксиды и гидроксиды. 8 класс Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин
Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин Материалы с малой плотностью
Материалы с малой плотностью Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Диеновые углеводороды CnH2n-2
Диеновые углеводороды CnH2n-2 Наноалмазы детонационного синтеза
Наноалмазы детонационного синтеза Влияние моющих средств на организм человека
Влияние моющих средств на организм человека 20230306_oni_byli_pervymi
20230306_oni_byli_pervymi Горно-химическое сырье
Горно-химическое сырье Оксиды в минералогии
Оксиды в минералогии Изомерия и ее виды
Изомерия и ее виды Основные электрохимические процессы
Основные электрохимические процессы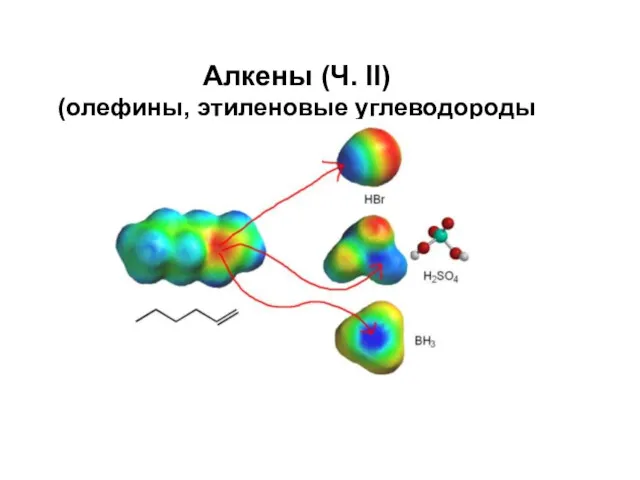 Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли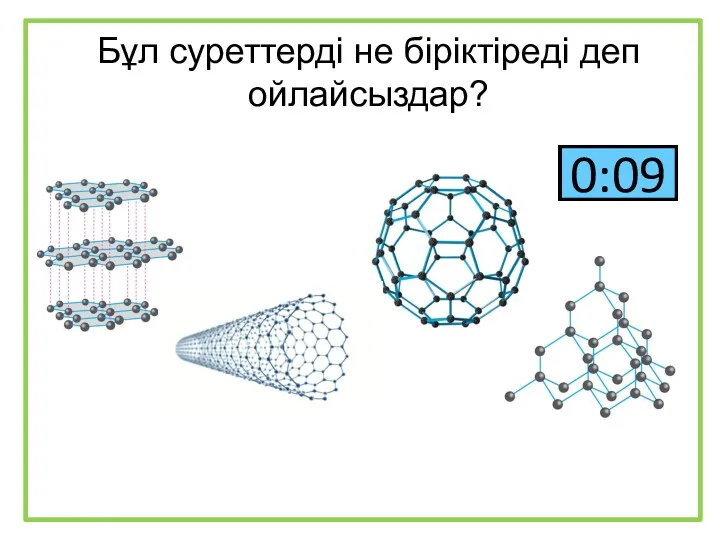 Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар?