Содержание
- 2. Гетероциклические соединения (ГЦ) циклические органические соединения, в которых имеется один или несколько гетероатомов – атомов элементов,
- 3. а) по имеющимся гетероатомам (N, O, S, P и др.) б) по длине (размерам) цикла пятичленные
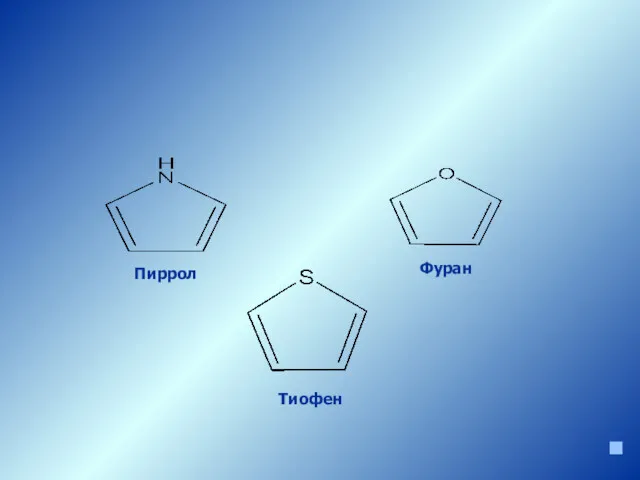
- 4. Пиррол Фуран Тиофен Гетероциклы с разными гетероатомами
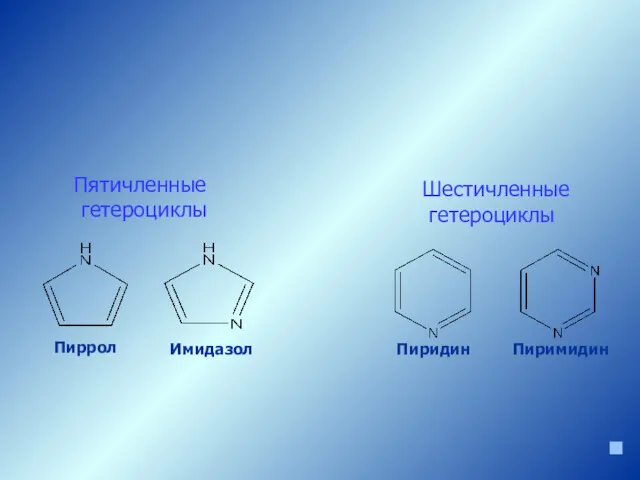
- 5. Пятичленные гетероциклы Шестичленные гетероциклы Пиррол Пиримидин Пиридин Имидазол Гетероциклы с разными размерами цикла
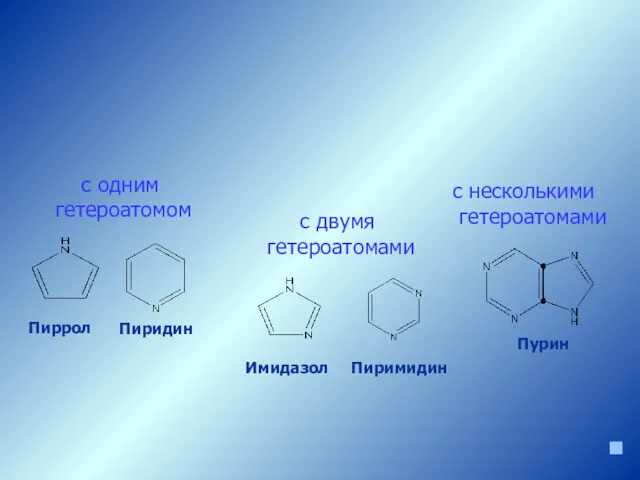
- 6. Пиррол Пиримидин Имидазол Пиридин с одним гетероатомом с двумя гетероатомами с несколькими гетероатомами Пурин Гетероциклы с
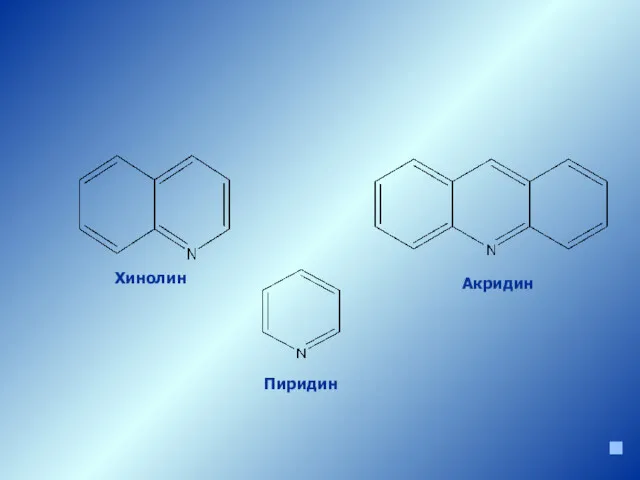
- 7. Пиридин Хинолин Акридин Гетероциклы с разным количеством циклов
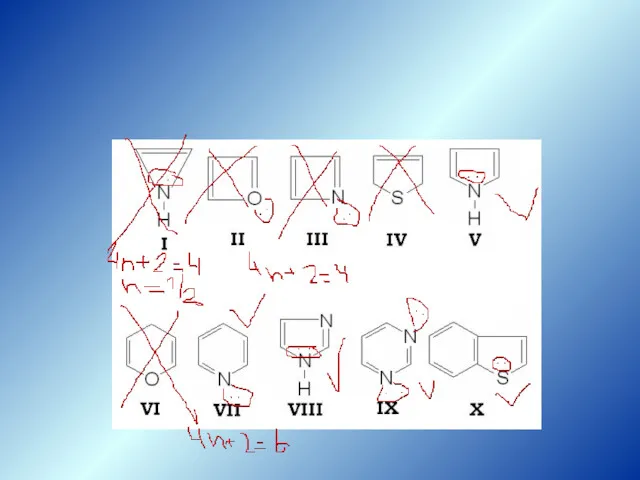
- 8. Пятичленные моногетероциклы: пиррол, фуран, тиофен; Шестичленные моногетероциклы: пиридин; Пятичленные дигетероциклы: оксазол, тиазол, имидазол, пиразол; Шестичленные дигетероциклы:
- 9. Ароматичность гетероциклических соединений
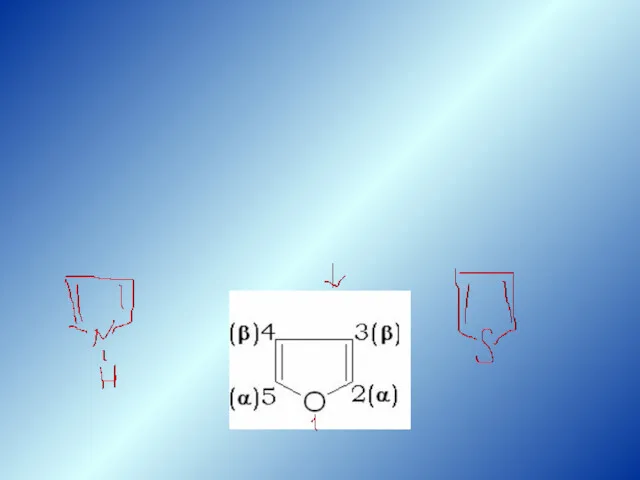
- 10. Пятичленные моногетероциклы: пиррол,фуран,тиофен
- 11. Название пиррола (красное масло) было дано Ф.Ф. Рунге (1834 г.), обнаружившим его в костяном масле (продукт
- 12. Дипольный момент пиррола равен 1,80d, направлен от азота внутрь цикла Строение пиррола
- 13. Лимприхт Генрих Франц Петер История открытия фурана Фуран в 1870г. открыл Г.Ф.П. Лимприхт путем перегонки бариевой
- 14. История открытия тиофена Тиофен выделил Мейер в 1852 г. из бензольной фракции каменноугольной смолы. Позже (1883
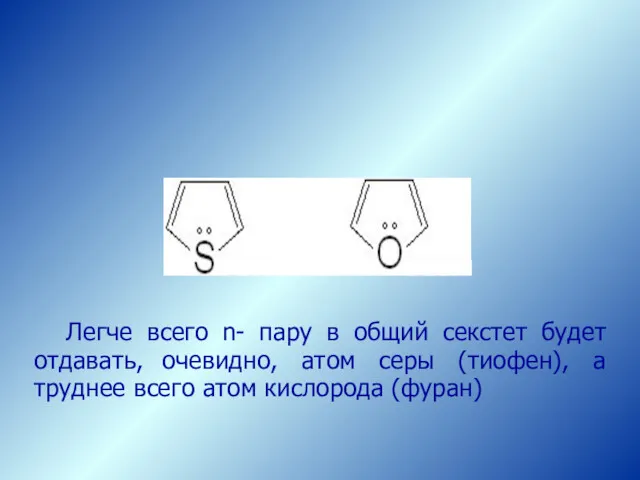
- 15. Легче всего n- пару в общий секстет будет отдавать, очевидно, атом серы (тиофен), а труднее всего
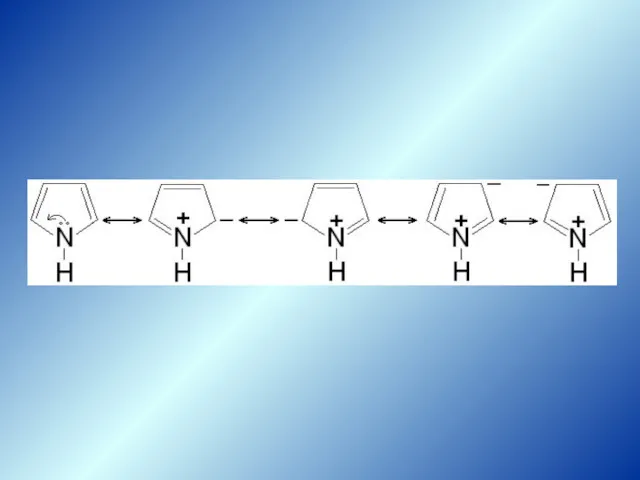
- 16. Строение пиррола предельные резонансные структурные формулы
- 17. Свойства пиррола, фурана, тиофена Пятичленные моногетероциклы, как ароматические системы, способны прежде всего вступать в реакции SЕ
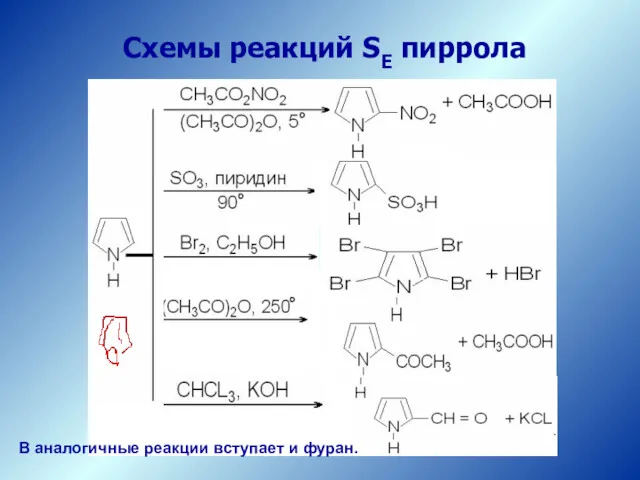
- 18. Схемы реакций SE пиррола В аналогичные реакции вступает и фуран.
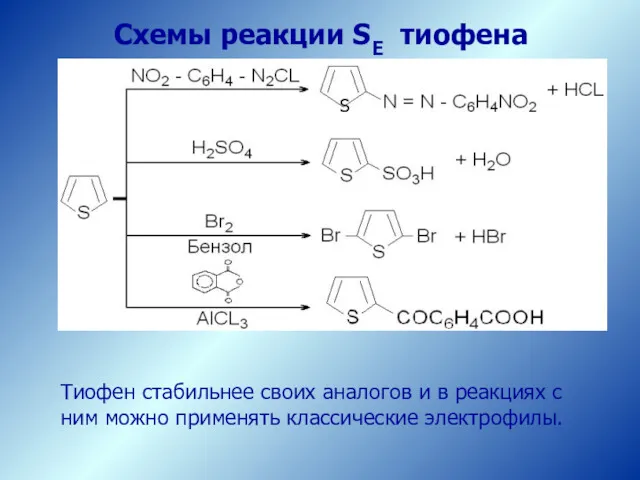
- 19. Схемы реакции SE тиофена Тиофен стабильнее своих аналогов и в реакциях с ним можно применять классические
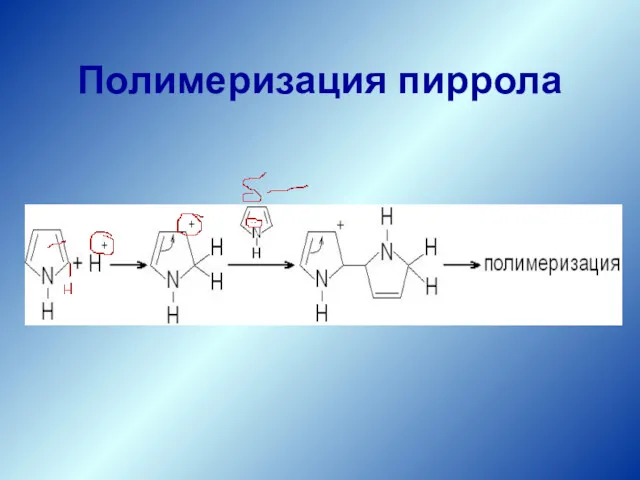
- 20. Полимеризация пиррола
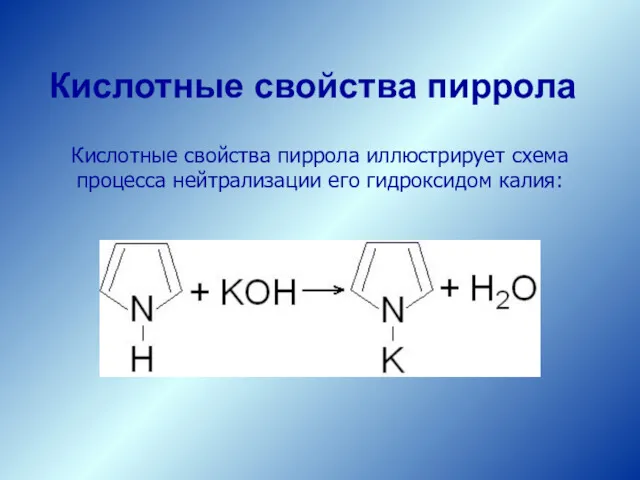
- 21. Кислотные свойства пиррола иллюстрирует схема процесса нейтрализации его гидроксидом калия: Кислотные свойства пиррола
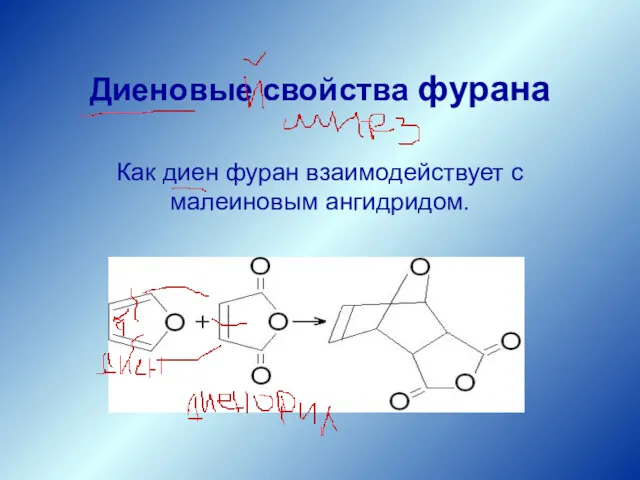
- 22. Как диен фуран взаимодействует с малеиновым ангидридом. Диеновые свойства фурана
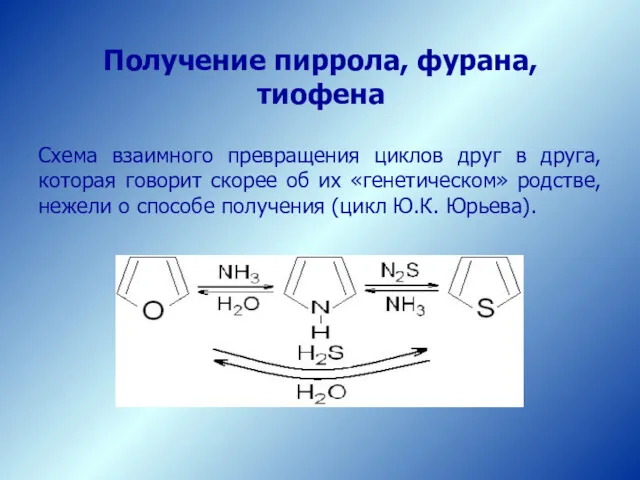
- 23. Получение пиррола, фурана, тиофена Схема взаимного превращения циклов друг в друга, которая говорит скорее об их
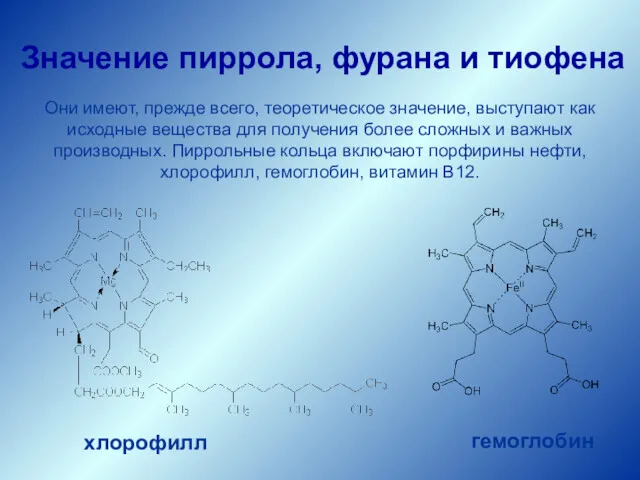
- 24. Они имеют, прежде всего, теоретическое значение, выступают как исходные вещества для получения более сложных и важных
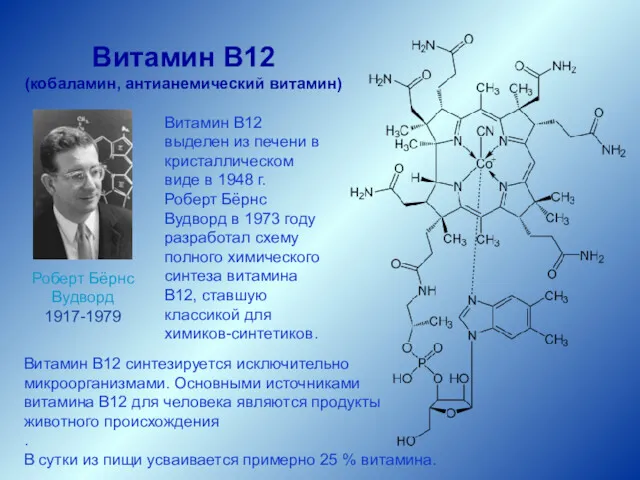
- 25. Витамин В12 (кобаламин, антианемический витамин) Витамин В12 выделен из печени в кристаллическом виде в 1948 г.
- 26. Шестичленные моногетероциклы на примере пиридина
- 27. История открытия В 1846 году шотландский химик Томас Андерсон из каменноугольной смолы выделил пиколин, а в
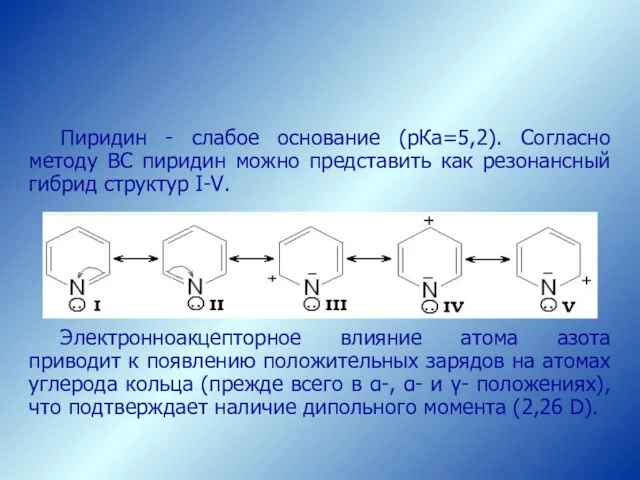
- 28. Пиридин - слабое основание (рКа=5,2). Согласно методу ВС пиридин можно представить как резонансный гибрид структур I-V.
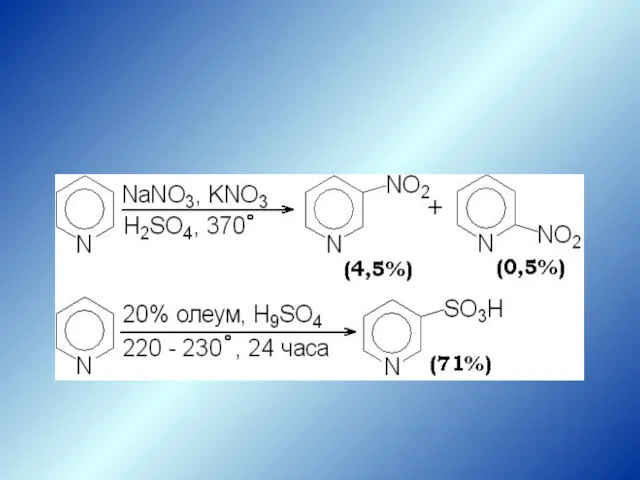
- 29. 1. Вследствие уменьшения электронной плотности на атомах углерода реакции SЕ должны быть затруднены по сравнению с
- 30. Реакции Se
- 31. Реакция А.Е. Чичибабина аминирование пиридинов (и хинолинов) амидами щелочных металлов, нуклеофильная частица –NH2 амид-анион. Реакции Sn
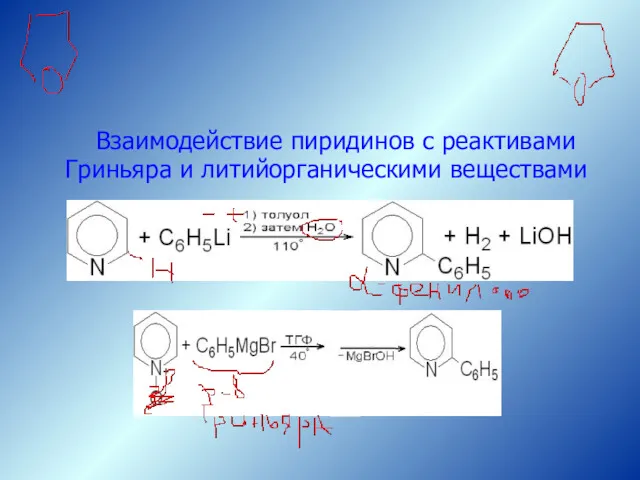
- 32. Взаимодействие пиридинов с реактивами Гриньяра и литийорганическими веществами Реакции Sn
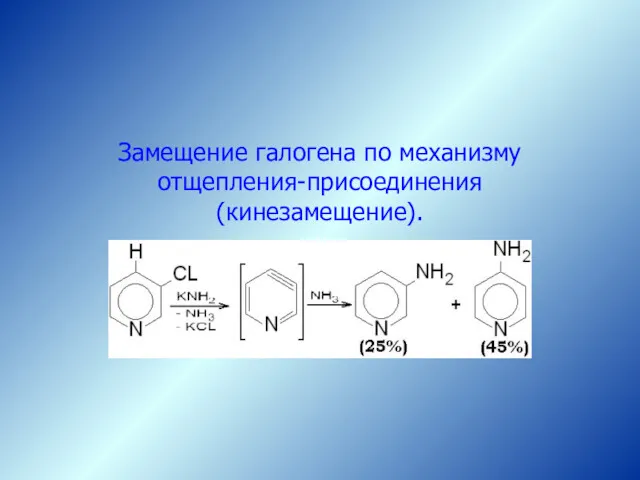
- 33. Реакции Sn Замещение галогена по механизму отщепления-присоединения (кинезамещение).
- 34. Реакция участия α- и γ- метильных групп с кислым атомом водорода в реакциях конденсации типа альдольно-кротоновой
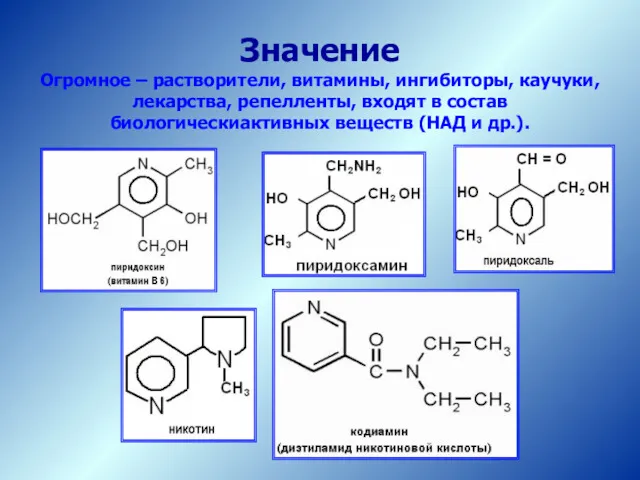
- 35. Значение Огромное – растворители, витамины, ингибиторы, каучуки, лекарства, репелленты, входят в состав биологическиактивных веществ (НАД и
- 37. Пятичленные дигетеромоноциклы азолы (на примере имидазола)
- 38. Строение Все азолы (имидазол, пиразол, оксазол, тиазол, изоксазол, изотиазол I-VI) – ароматические гетероциклы. В «ароматическом секстете»
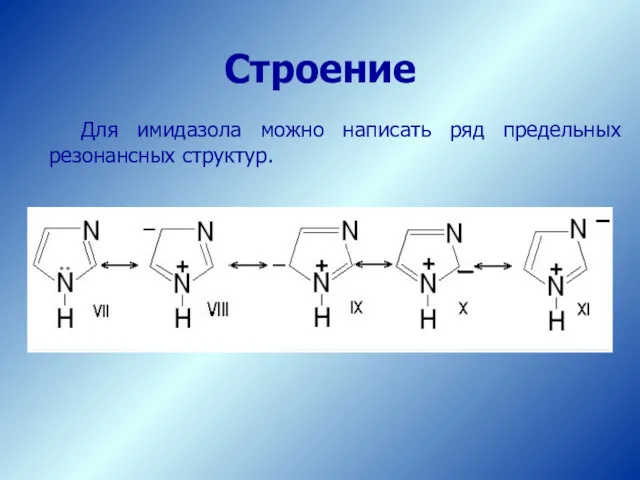
- 39. Для имидазола можно написать ряд предельных резонансных структур. Строение
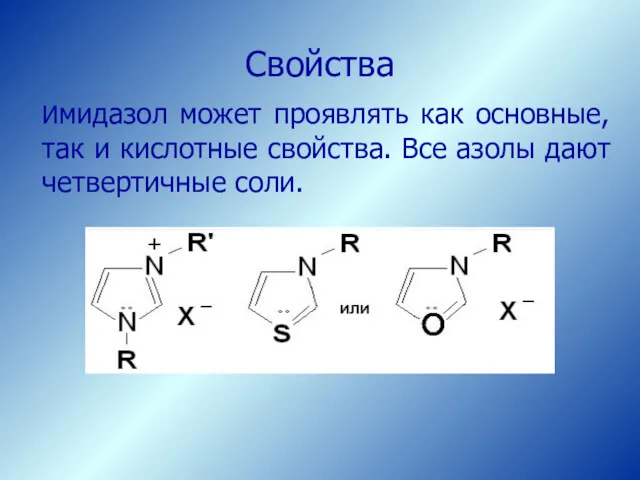
- 40. Свойства Имидазол может проявлять как основные, так и кислотные свойства. Все азолы дают четвертичные соли.
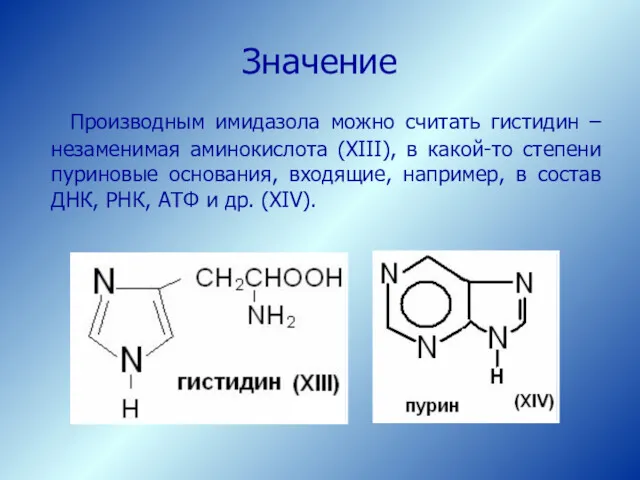
- 41. Значение Производным имидазола можно считать гистидин – незаменимая аминокислота (XIII), в какой-то степени пуриновые основания, входящие,
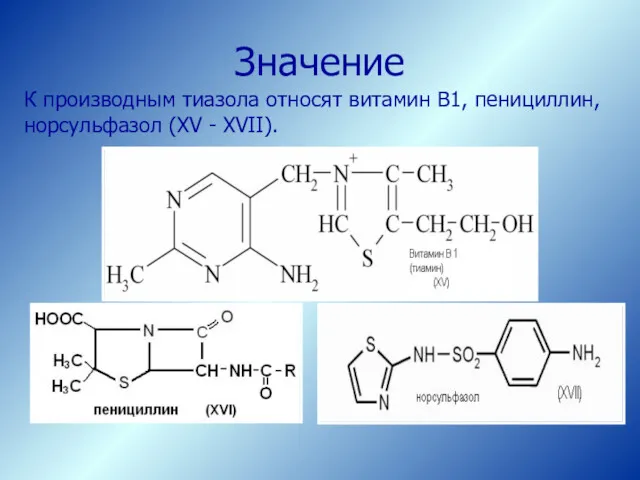
- 42. К производным тиазола относят витамин В1, пенициллин, норсульфазол (XV - XVII). Значение
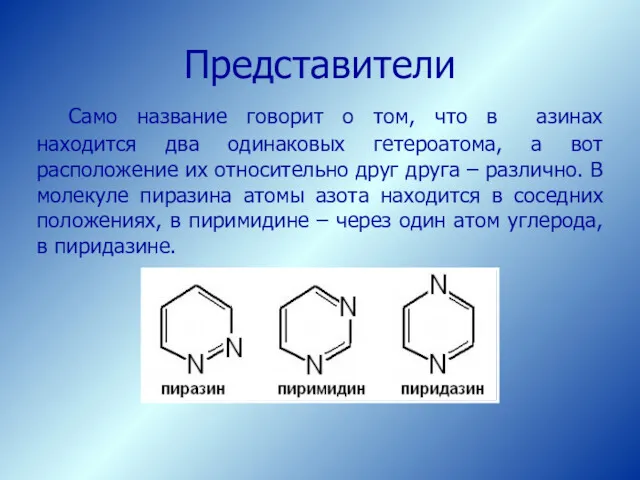
- 43. Шестичленные дигетеромоноциклы азины пиразин, пиримидин, пиридазин
- 44. Само название говорит о том, что в азинах находится два одинаковых гетероатома, а вот расположение их
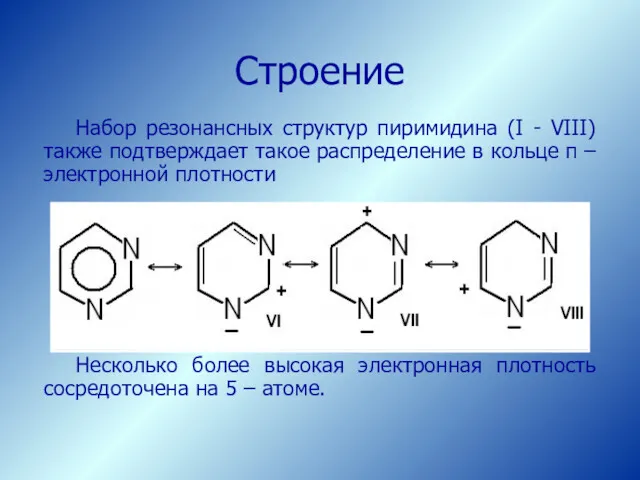
- 45. Набор резонансных структур пиримидина (I - VIII) также подтверждает такое распределение в кольце π – электронной
- 46. Свойства Реакции SЕ (из-за малой нуклеофильности) пиримидина становится практически невозможными. Жесткое нитрование приводит к малому выходу
- 47. История открытия Получен Габриэлем в 1889 г из барабитуровой кислоты. Фенилметилоксипиримидин получен ранее в 1884 г
- 50. Конденсированные бициклические моногетеросоединения на примере индола
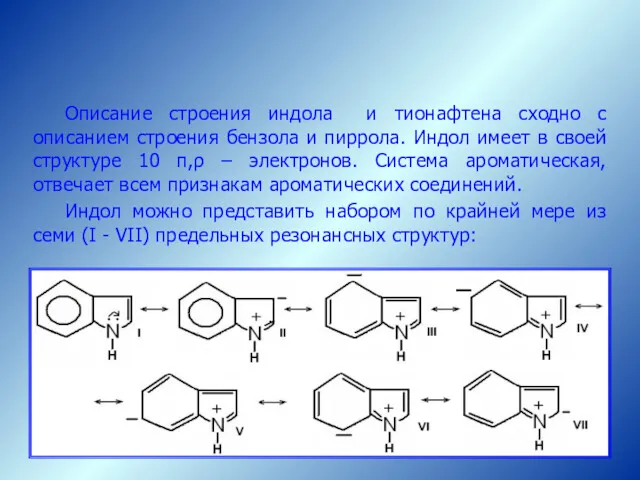
- 51. Описание строения индола и тионафтена сходно с описанием строения бензола и пиррола. Индол имеет в своей
- 52. Наибольший вклад в стабилизацию молекул индола вносят структуры I и II, т.к. только в этих структурах
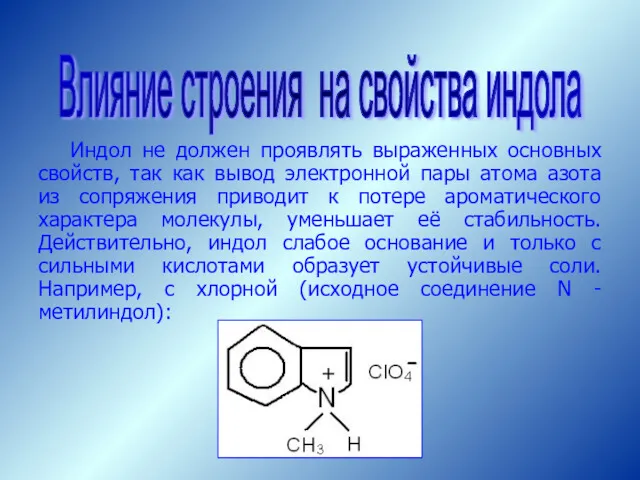
- 53. Индол не должен проявлять выраженных основных свойств, так как вывод электронной пары атома азота из сопряжения
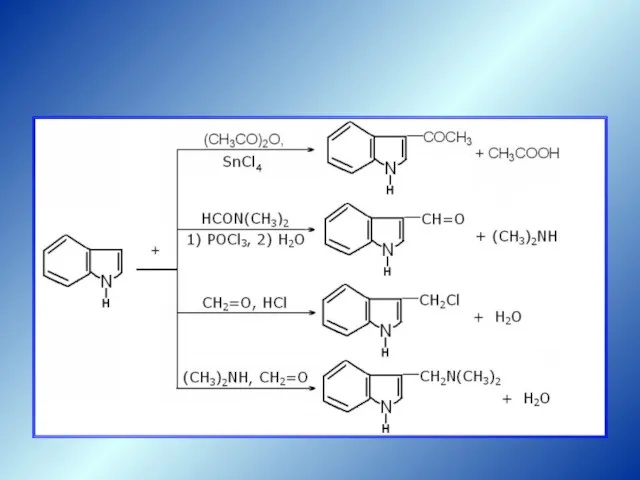
- 54. Индол способен вступать в реакции SЕ, т.к. атомы углерода в пиррольной (особенно положение 3 или β)
- 55. Скорость реакции SЕ у индола ниже, чем у пиррола (сказывается влияние бензольного ядра). Наиболее типичны с
- 56. Реакции Se
- 57. Классические реакции SЕ-типа – нитрования, сульфирования, галогенирования в присутствии кислот Льюиса вследствие малой устойчивости цикла индола
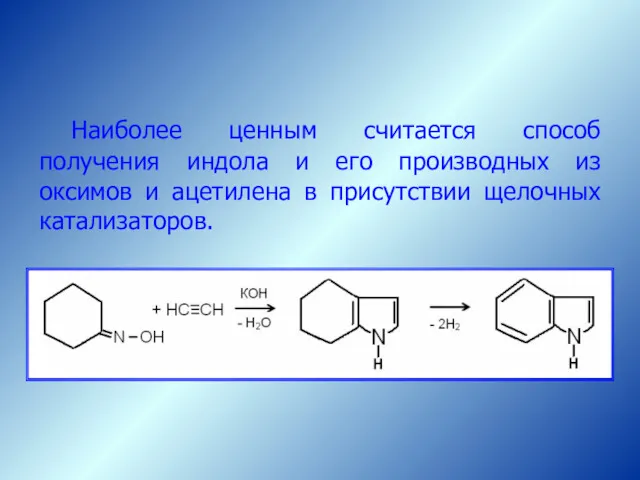
- 58. Наиболее ценным считается способ получения индола и его производных из оксимов и ацетилена в присутствии щелочных
- 59. История открытия Индол получен в 1869 г. Байером и Эммерлингом из о-нитрокоричной кислоты. Они же предсказали
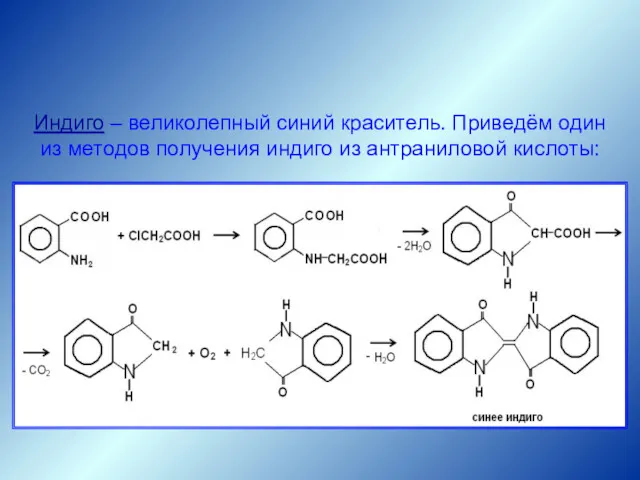
- 60. Получение индиго Индиго – великолепный синий краситель. Приведём один из методов получения индиго из антраниловой кислоты:
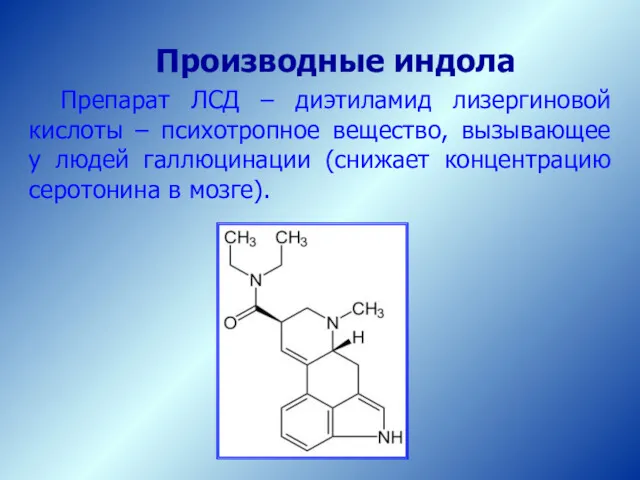
- 61. Производные индола Препарат ЛСД – диэтиламид лизергиновой кислоты – психотропное вещество, вызывающее у людей галлюцинации (снижает
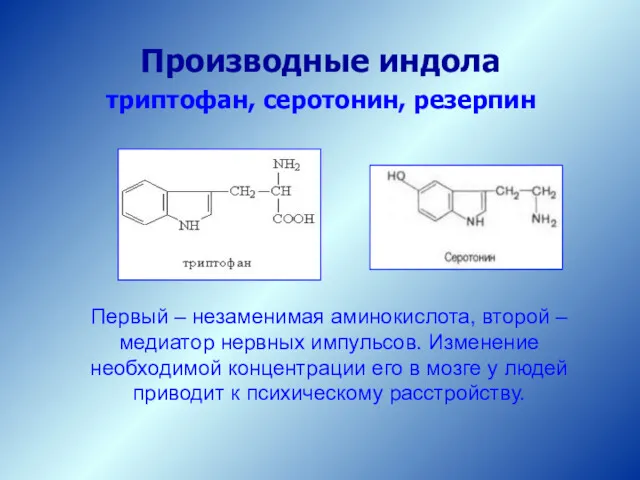
- 62. Производные индола триптофан, серотонин, резерпин Первый – незаменимая аминокислота, второй – медиатор нервных импульсов. Изменение необходимой
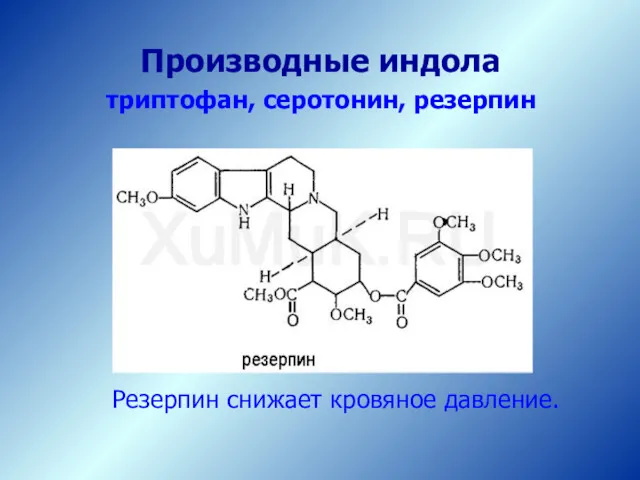
- 63. Резерпин снижает кровяное давление. Производные индола триптофан, серотонин, резерпин
- 64. Хинолин Конденсированные шестичленные гетероциклы с одним гетероатомом
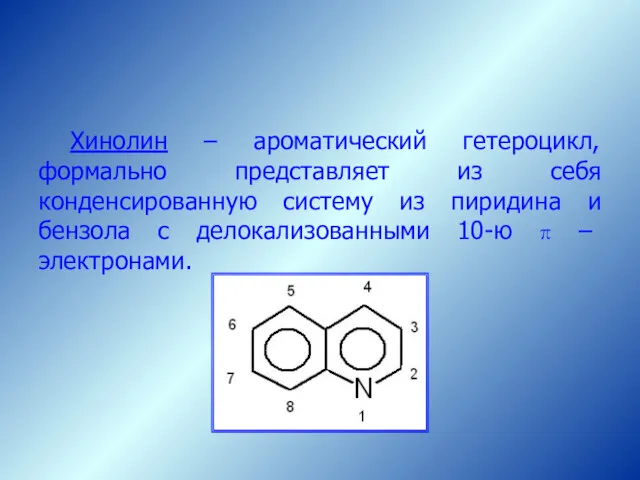
- 65. Хинолин – ароматический гетероцикл, формально представляет из себя конденсированную систему из пиридина и бензола с делокализованными
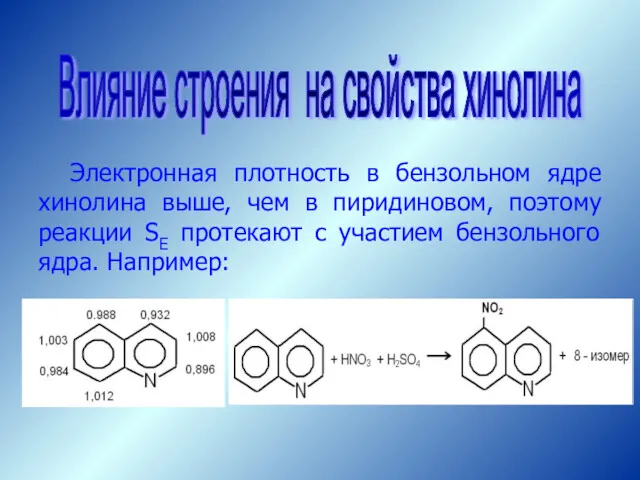
- 66. Электронная плотность в бензольном ядре хинолина выше, чем в пиридиновом, поэтому реакции SЕ протекают с участием
- 67. Влияние строения на свойства хинолина Азот хинолина сохраняет свободную электронную пару и способен к образованию дополнительной
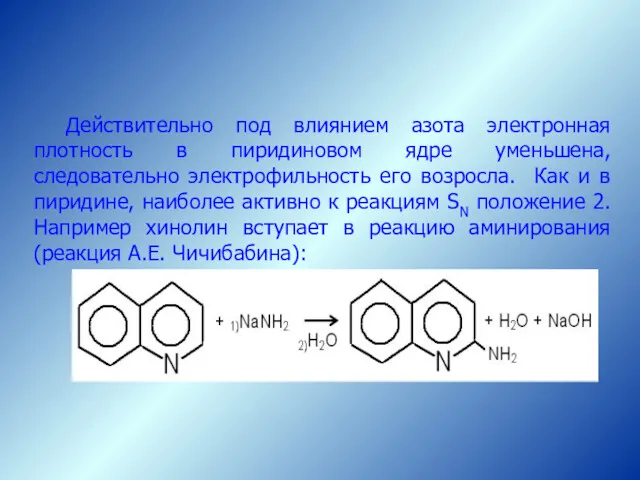
- 68. Действительно под влиянием азота электронная плотность в пиридиновом ядре уменьшена, следовательно электрофильность его возросла. Как и
- 69. В результате окисления хинолин превращается преимущественно в пиридинкарбоновую кислоту, что подтверждает большую стабильность пиридинового ядра. Реакции
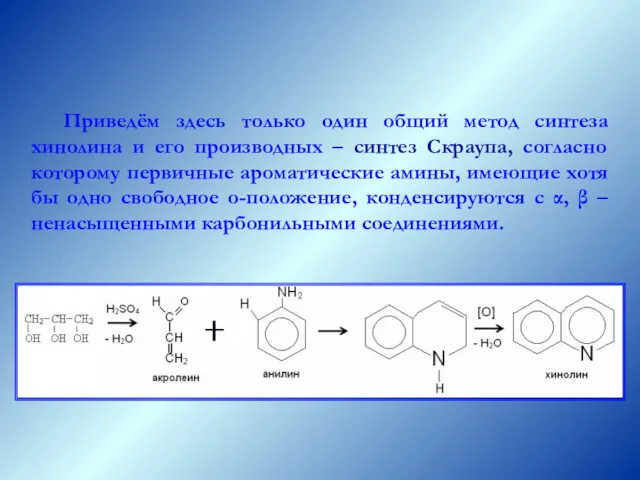
- 70. Приведём здесь только один общий метод синтеза хинолина и его производных – синтез Скраупа, согласно которому
- 71. История открытия Открыт Рунге в 1834 г. в каменноугольной смоле. В 1842 году он получен Жераром
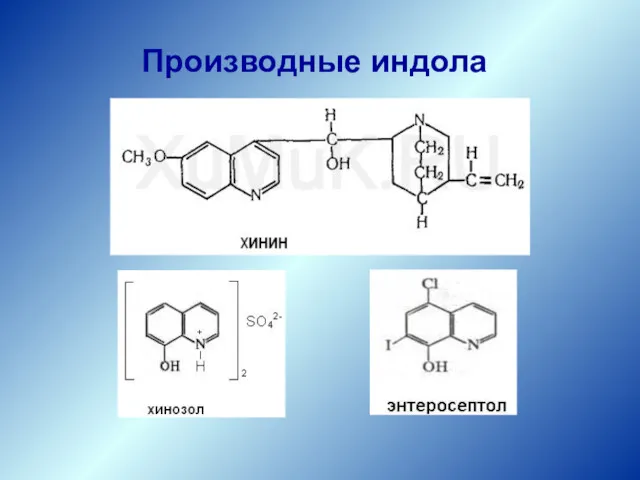
- 72. Производные индола
- 73. Конденсированные бициклические полигетеросоединения (на примере пурина)
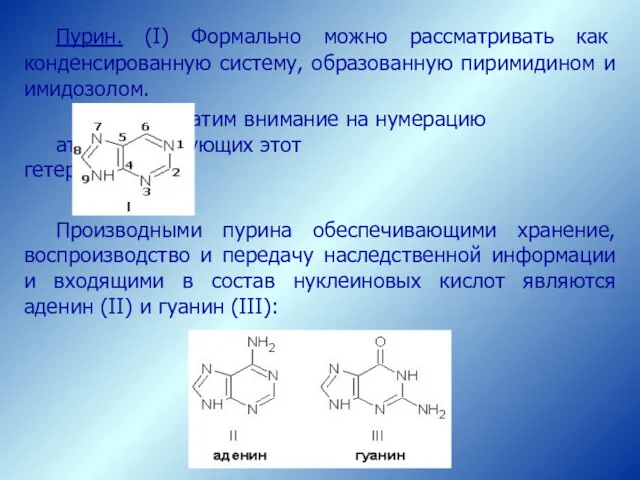
- 74. Пурин. (I) Формально можно рассматривать как конденсированную систему, образованную пиримидином и имидозолом. Обратим внимание на нумерацию
- 75. Нуклеиновые кислоты – высокомолекулярные, водорастворимые биополимеры, которые при гидролизе образуют эквимолекулярну. Смесь гетероциклических оснований, пентоз и
- 76. Гидролиз нуклеопротеидов осуществляется в следующей последовательности: Нуклеопротеиды Нуклеиновые кислоты + белок Нуклеотиды Нуклеозиды + фосфорная кислота
- 78. Скачать презентацию


































 Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Олигомеризация олефинов
Олигомеризация олефинов Природные источники углеводородов
Природные источники углеводородов Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Кристалогідрати. Номенклатура, найважливіші кристалогідрати та їх застосування
Кристалогідрати. Номенклатура, найважливіші кристалогідрати та їх застосування Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Дисперсные системы
Дисперсные системы Оксиди нітрогену
Оксиди нітрогену Серная кислота H2SO4. 9 классы
Серная кислота H2SO4. 9 классы Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Химическая связь
Химическая связь Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Подгруппа углерода
Подгруппа углерода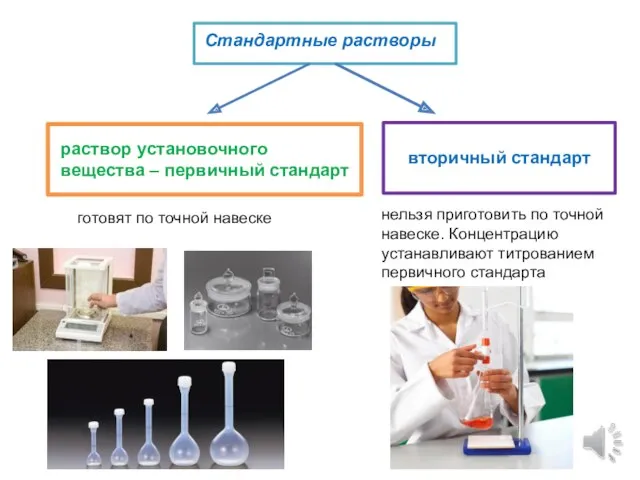 Способы выражения концентраций растворов, используемые в титриметрии
Способы выражения концентраций растворов, используемые в титриметрии Физические явления – основа разделения смесей в химии (урок химии в 8 классе)
Физические явления – основа разделения смесей в химии (урок химии в 8 классе) Використання кислот
Використання кислот Щелочные металлы
Щелочные металлы Благородные газы
Благородные газы Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Чипсы: польза или вред. Химия
Чипсы: польза или вред. Химия Електроліти
Електроліти Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution
Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution Начало нанотехнологической эры. Фуллерены
Начало нанотехнологической эры. Фуллерены Растворы электролитов
Растворы электролитов