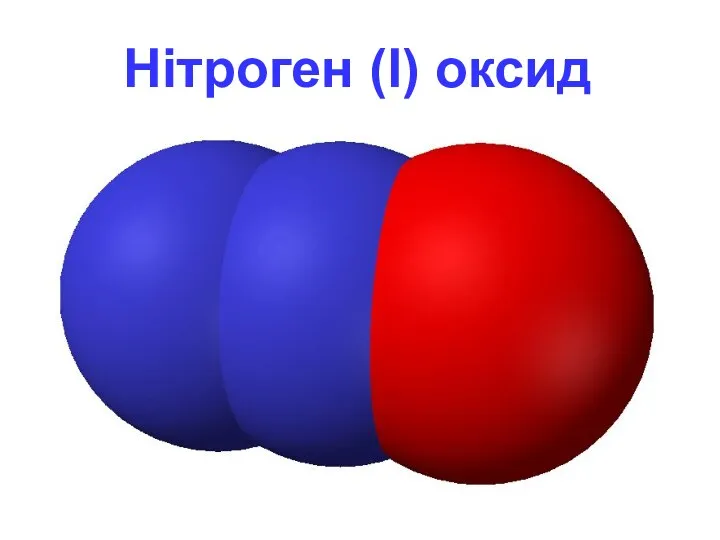
N2O - нітроген (I) оксид
«звеселяючий газ» - створює сміхотворний ефект.
Фізичні властивості
Безбарвний
газ, важчий за повітря, з характерним солодкуватим запахом і смаком. Розчинний у воді.
При 0 ° C і тиску 30 атм, а також при кімнатній температурі і тиску 40 атм згущується в безбарвну рідину. З 1 кг рідкого закису азоту утворюється 500 л газу. Не запалюється, але підтримує горіння.
Хімічні властивості
Несолетвірний оксид.
За нормальних умов N2O хімічно інертний, при нагріванні проявляє властивості окиснювача:
N2O + H2 → N2↑ + H2O
При взаємодії з сильними окиснювачами може проявляти властивості відновника:
5N2О + 8KMnO4 + 7H2SO4 →
5Mn(NO3)2+ 3MnSO4 + 4K2SO4 + 7H2O
При нагріванні розкладається на азот і кисень










 Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Катализ в органическом синтезе
Катализ в органическом синтезе Конденсация. Капельная и пленочная конденсация
Конденсация. Капельная и пленочная конденсация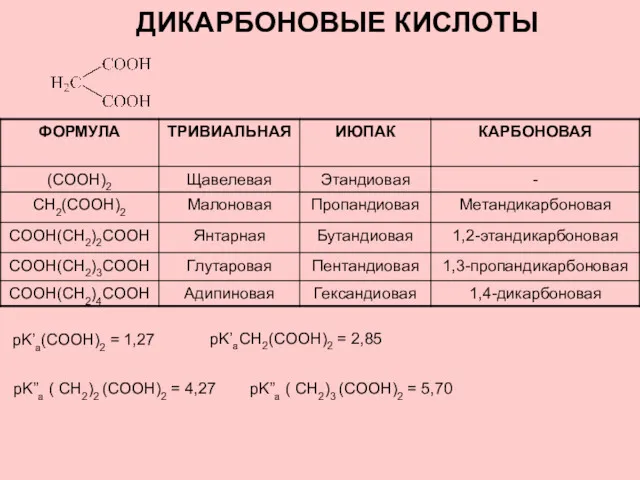 Дикарбоновые кислоты
Дикарбоновые кислоты Классификация химических веществ СГС
Классификация химических веществ СГС Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Введение в органическую химию
Введение в органическую химию Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества Методы разделения смесей веществ
Методы разделения смесей веществ Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО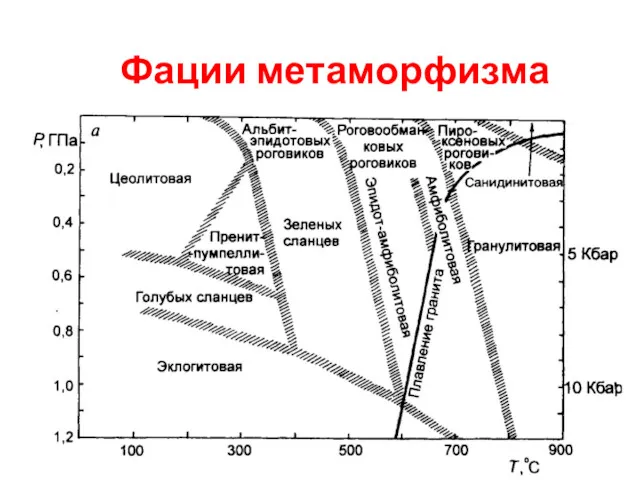 Фации метаморфизма
Фации метаморфизма Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки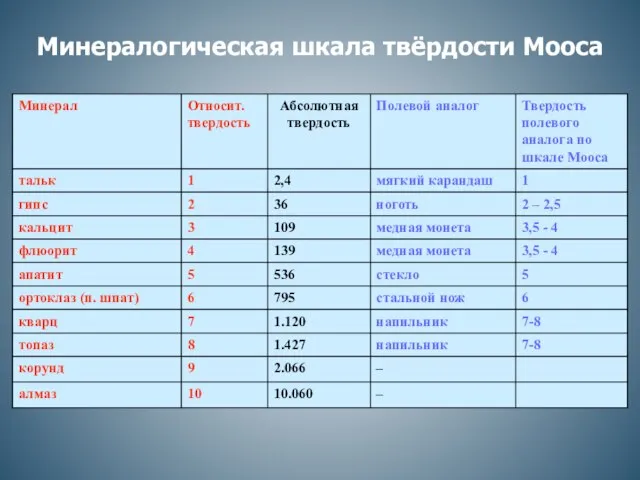 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Теория электролитической диссоциации
Теория электролитической диссоциации Кислород
Кислород Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Кристаллы. Формы
Кристаллы. Формы Электролитическая диссоциация. Гидролиз
Электролитическая диссоциация. Гидролиз Белки. Функции белков
Белки. Функции белков Сплавы металлов. 11 класс
Сплавы металлов. 11 класс Химические свойства. Оксиды, основания, кислоты и соли
Химические свойства. Оксиды, основания, кислоты и соли Целлюлоза
Целлюлоза Water
Water Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов