Содержание
- 2. Щавелевая кислота Получение 1. Окисление глюкозы или сахарозы азотной кислотой 2. В промышленности 3. Окисление этиленгликоля
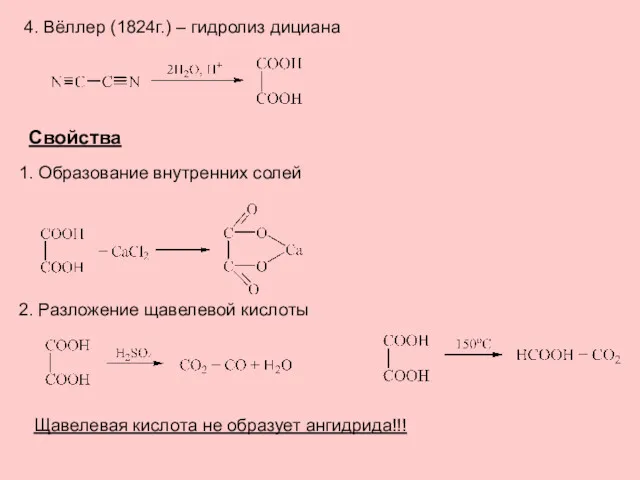
- 3. 4. Вёллер (1824г.) – гидролиз дициана Свойства 1. Образование внутренних солей 2. Разложение щавелевой кислоты Щавелевая
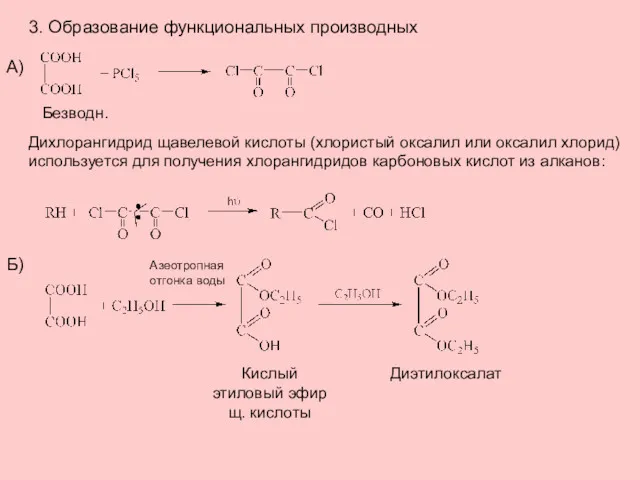
- 4. 3. Образование функциональных производных Безводн. Дихлорангидрид щавелевой кислоты (хлористый оксалил или оксалил хлорид) используется для получения
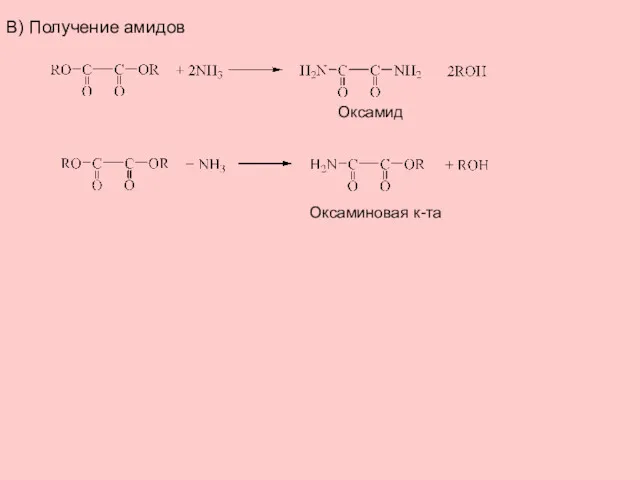
- 5. В) Получение амидов Оксамид Оксаминовая к-та
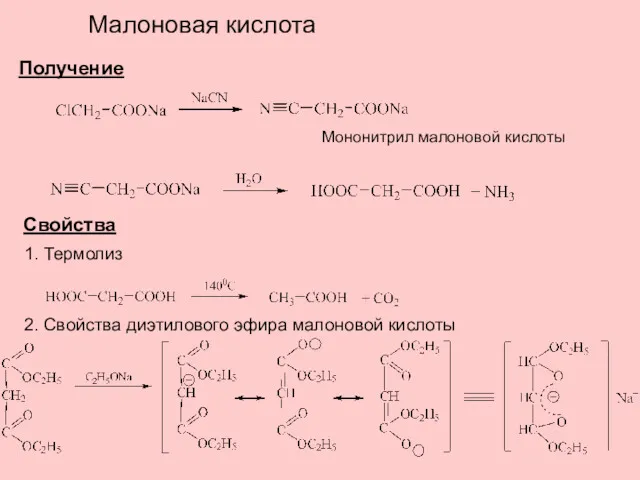
- 6. Малоновая кислота Получение Мононитрил малоновой кислоты Свойства 1. Термолиз 2. Свойства диэтилового эфира малоновой кислоты
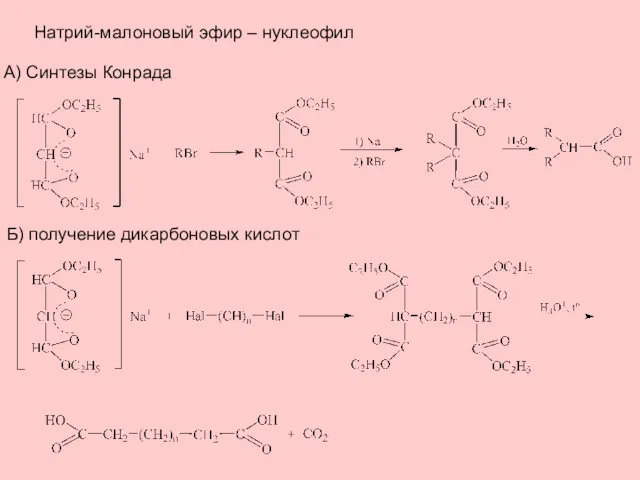
- 7. Натрий-малоновый эфир – нуклеофил А) Синтезы Конрада Б) получение дикарбоновых кислот
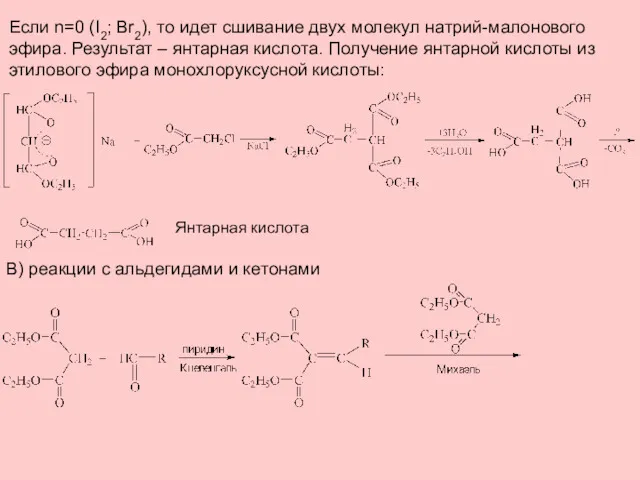
- 8. Если n=0 (I2; Br2), то идет сшивание двух молекул натрий-малонового эфира. Результат – янтарная кислота. Получение
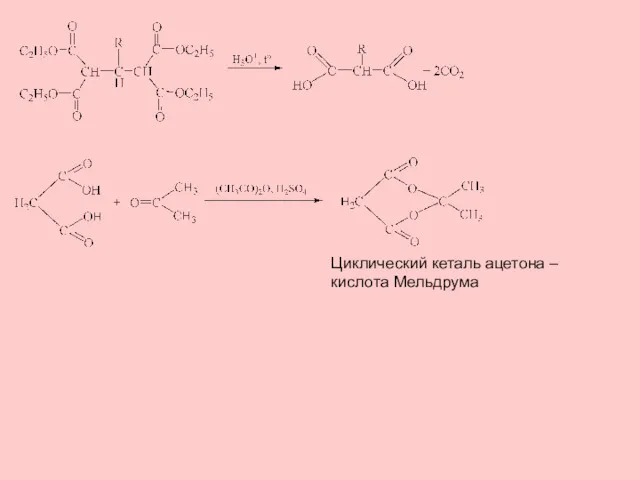
- 9. Циклический кеталь ацетона – кислота Мельдрума
- 10. Янтарная кислота Получение 1. Метод Конрада (см. выше) 2. Свойства 1. Янтарная кислота легко образует циклические
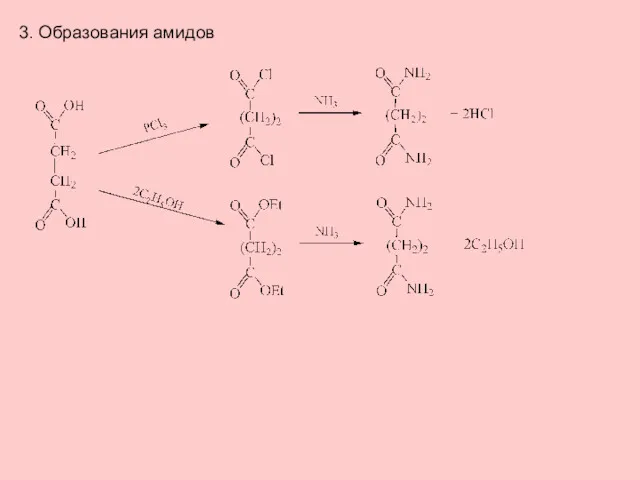
- 11. 3. Образования амидов
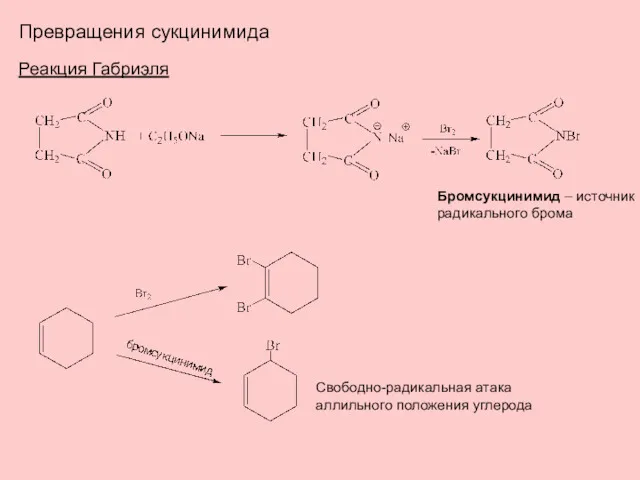
- 12. Превращения сукцинимида Реакция Габриэля Бромсукцинимид – источник радикального брома Свободно-радикальная атака аллильного положения углерода
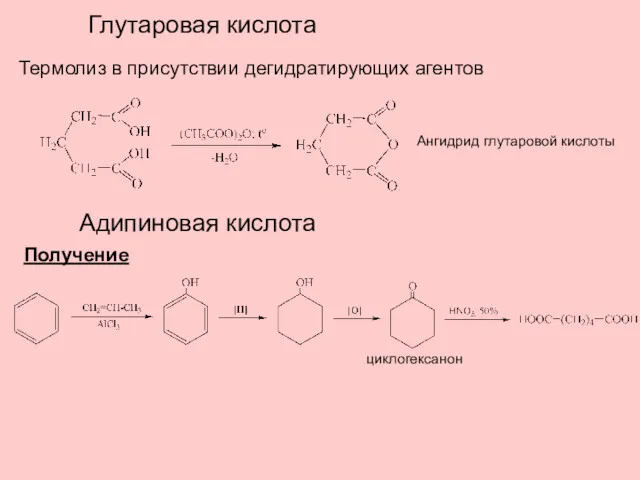
- 13. Глутаровая кислота Термолиз в присутствии дегидратирующих агентов Ангидрид глутаровой кислоты Адипиновая кислота Получение циклогексанон
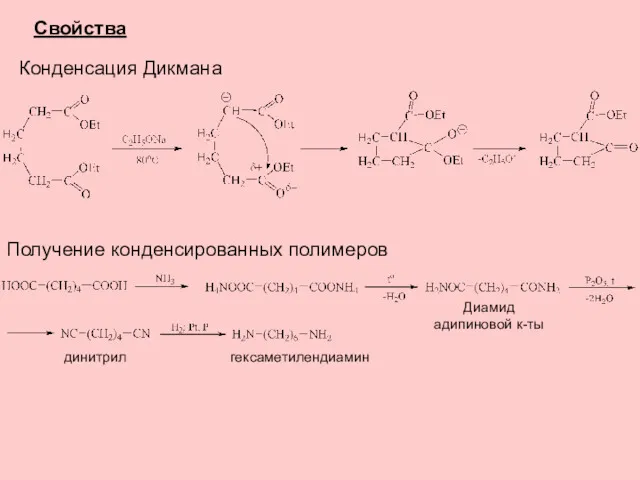
- 14. Свойства Конденсация Дикмана Диамид адипиновой к-ты Получение конденсированных полимеров динитрил гексаметилендиамин
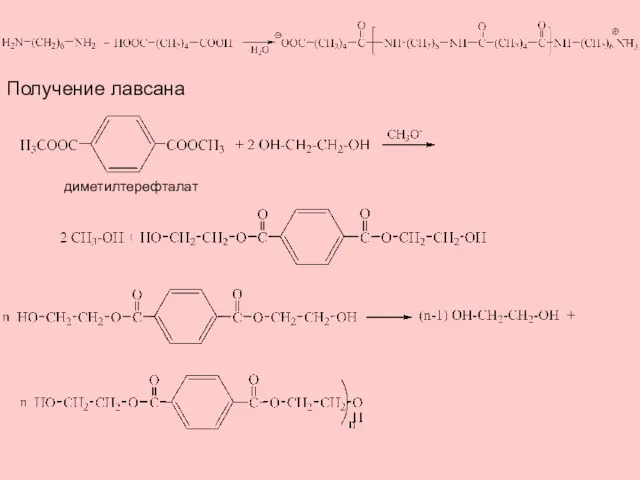
- 15. Получение лавсана диметилтерефталат
- 16. ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ α – гидроксимасляная к-та 2-гидроксибутановая к-та Гидроксиуксусная, гликолевая Молочная (DL, D, L) α –
- 17. 2-гидрокси-1,2,3-пропантрикарбоновая к-та (лимонная) гидроксимуравьиная к-та (угольная) Способы получения α - гидроксикислоты 1. Циангидринный синтез Циангидрин ацетона
- 18. 2. Гидролиз α-галогензамещенных кислот Монобромуксусная к-та Гликолевая к-та 3. Восстановление α-галогензамещенных кислот Молочная к-та 4. Бактериальное
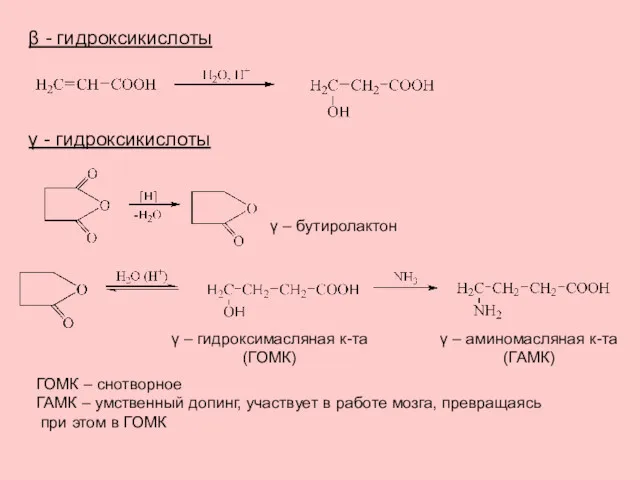
- 19. β - гидроксикислоты γ - гидроксикислоты γ – бутиролактон γ – гидроксимасляная к-та (ГОМК) ГОМК –
- 21. Скачать презентацию





 Теоретические основы органической химии
Теоретические основы органической химии Кислоты, их классификация и свойства в свете ТЭД
Кислоты, их классификация и свойства в свете ТЭД Основания. 8 класс
Основания. 8 класс Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Накопление химических знаний в доисторические времена
Накопление химических знаний в доисторические времена Установка гидрокрекинга
Установка гидрокрекинга Аналитическая химия. Кислотно-основное титрование
Аналитическая химия. Кислотно-основное титрование Амфотерность
Амфотерность Oxygen, O2
Oxygen, O2 Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Гидролиз неорганических солей
Гидролиз неорганических солей Предельные углеводороды
Предельные углеводороды Галогены. Хлор
Галогены. Хлор Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Тепловой эффект химических реакций
Тепловой эффект химических реакций Группа редкоземельных элементов
Группа редкоземельных элементов Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Сероводород, сернистый водород
Сероводород, сернистый водород Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химический элемент - водород
Химический элемент - водород Соли
Соли Теория электролитической диссоциации (ТЭД), ионные уравнения
Теория электролитической диссоциации (ТЭД), ионные уравнения Производство серной кислоты
Производство серной кислоты Металл серебро
Металл серебро