Содержание
- 2. Краткая характеристика элемента H 1 1,00794 1s1 Водород Водоро́д — первый элемент периодической системы элементов. Широко
- 3. Происхождение названия Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γενναω — «рождаю»)
- 4. Распространенность Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех
- 5. Химические свойства Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию,
- 6. Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3 С галогенами образует галогеноводороды: F2
- 7. Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na +
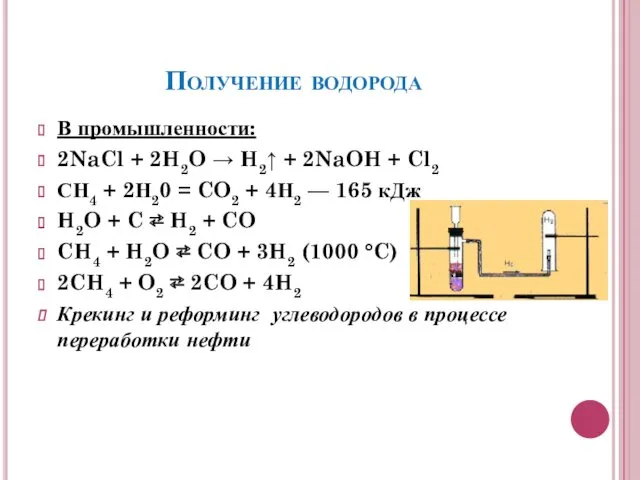
- 8. Получение водорода В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20
- 9. В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑
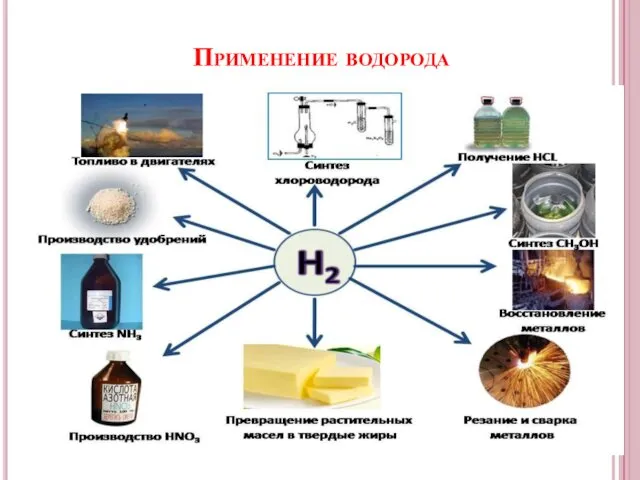
- 10. Применение водорода
- 12. Скачать презентацию







 Цинк
Цинк Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Якісні реакції на деякі йони
Якісні реакції на деякі йони Основні класи неорганічних сполук
Основні класи неорганічних сполук Происхождение химических элементов
Происхождение химических элементов Анализ лекарственных форм
Анализ лекарственных форм Форми періодичної системи хімічних елементів
Форми періодичної системи хімічних елементів Періодичний закон. Хімія. 8 клас
Періодичний закон. Хімія. 8 клас Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Углеводороды
Углеводороды Synthesis of Paclitaxel
Synthesis of Paclitaxel Современные представления о катализе. Общие закономерности гетерогенного катализа
Современные представления о катализе. Общие закономерности гетерогенного катализа Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми Керамические материалы
Керамические материалы Приготування розчинів
Приготування розчинів Общая и неорганическая химия
Общая и неорганическая химия Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Альдегиды и кетоны
Альдегиды и кетоны Оксид серы(4). Сернистая кислота и её соли
Оксид серы(4). Сернистая кислота и её соли Элементы группы галогенов
Элементы группы галогенов Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Химическая кинетика
Химическая кинетика Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Алюминий. Строение
Алюминий. Строение Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Строение атома. Лекция 2
Строение атома. Лекция 2 Классификация химических элементов
Классификация химических элементов Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов