Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) презентация
Содержание
- 2. Здравствуйте! Здравствуйте, гости дорогие! Чем так опечалены на уроке химии? Расскажите мне скорей: На каком уроке,
- 3. Проверка домашнего задания. По традиции опять Начинаем как обычно Мы «домашку» проверять. Это ведь для нас
- 4. ПРОВЕРОЧНЫЙ ТЕСТ Задание 1: подбери соответствие. 1.Аргентум 2.Аурум 3.Гидраргирум 4.Силициум 5.Натрий 6.Плюмбум 7.Фосфор 8.Кальций 9.Купрум 10.Феррум
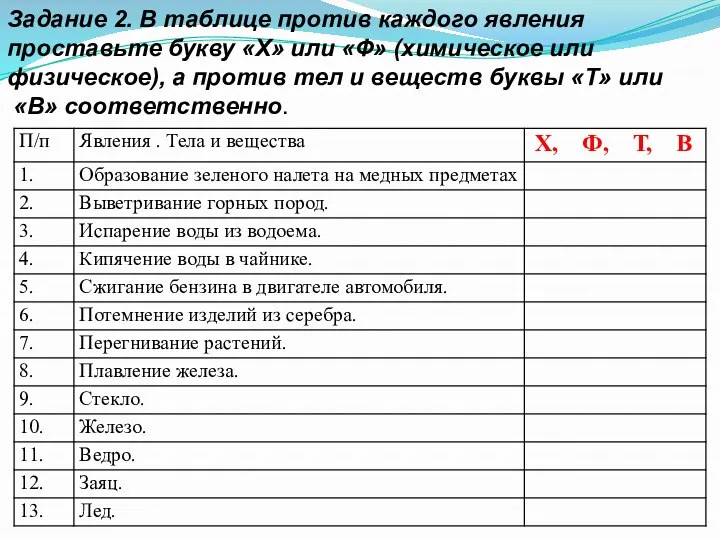
- 5. Задание 2. В таблице против каждого явления проставьте букву «Х» или «Ф» (химическое или физическое), а
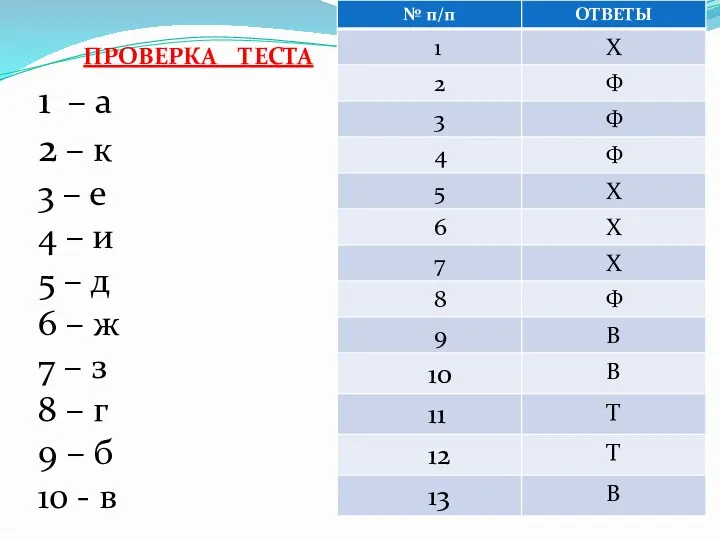
- 6. ПРОВЕРКА ТЕСТА 1 – а 2 – к 3 – е 4 – и 5 –
- 7. Оценки: « 5 » - 20 - 23 балла « 4 » - 16 - 19
- 8. 3.«Формула вещества». Что может формула сказать О разных веществах? Ты сможешь многое узнать, Ведь все в
- 9. ФОРМУЛЫ ВЕЩЕСТВ H - один атом водорода H₂ - одна молекула водорода H₂SO₄ - одна молекула
- 10. Молекул сколько вещества Определишь в момент, Когда внимательно взглянёшь На коэффициент. А где же нам его
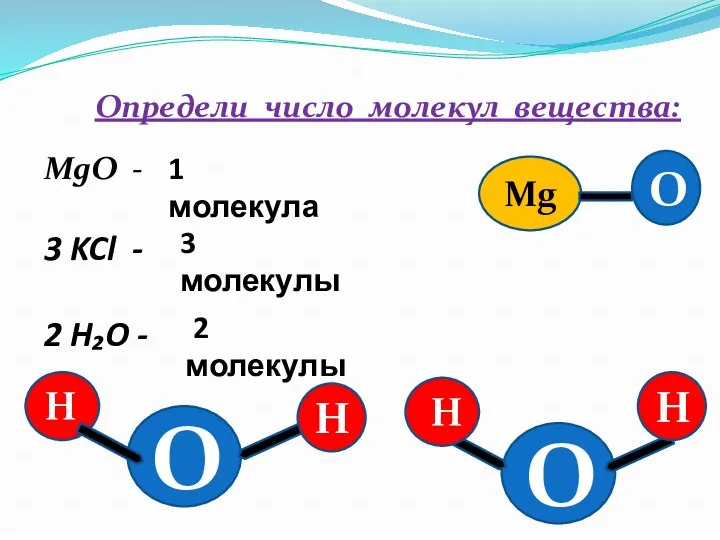
- 11. Определи число молекул вещества: MgO - 3 KCl - 2 H₂O - 1 молекула 3 молекулы
- 12. Число молекул разобрали. А как же с атомами быть? Как нам узнать, что мы не знали:
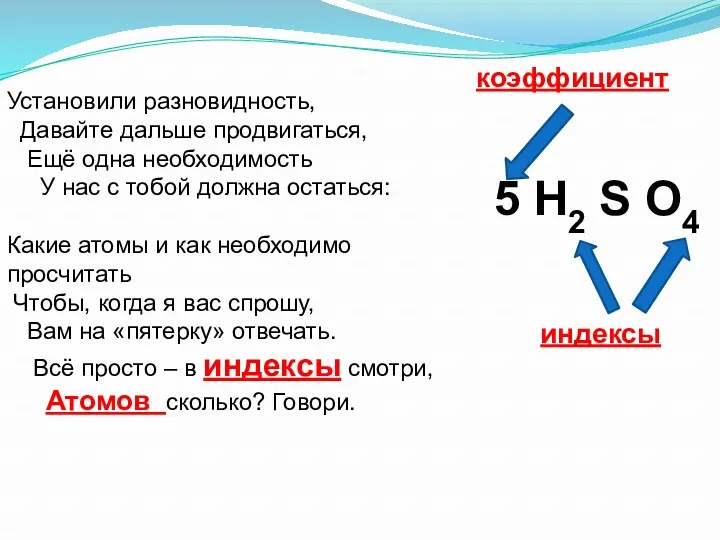
- 13. Установили разновидность, Давайте дальше продвигаться, Ещё одна необходимость У нас с тобой должна остаться: Какие атомы
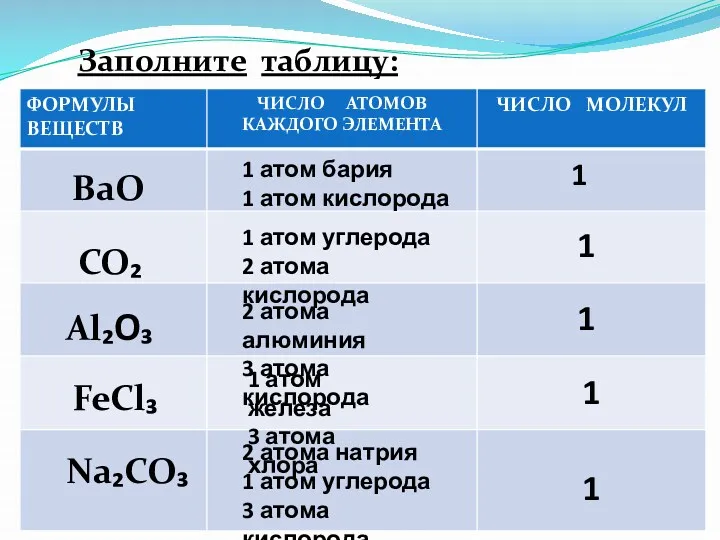
- 14. BaO CO₂ Al₂O₃ FeCl₃ Na₂CO₃ Заполните таблицу: 1 атом бария 1 атом кислорода 1 атом углерода
- 15. Индекс и коэффициент Спутать не так просто, Цифра индекса совсем Маленького роста. А коль молекул много,
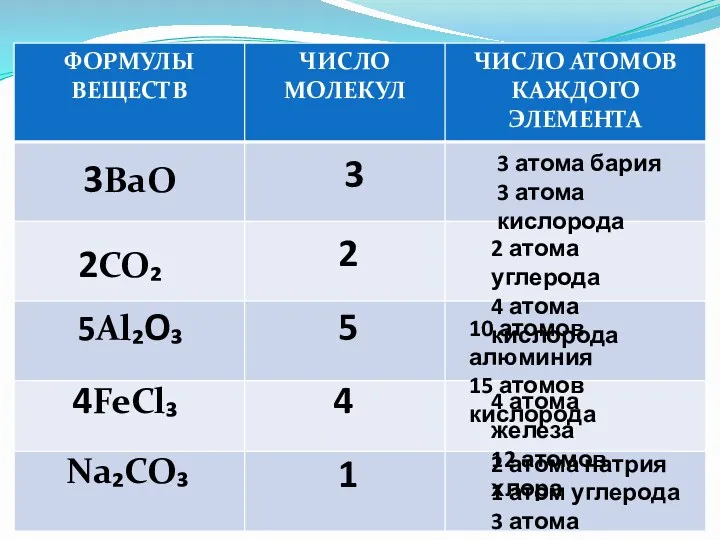
- 16. 3BaO 2CO₂ 5Al₂O₃ 4FeCl₃ Na₂CO₃ 3 2 5 4 1 2 атома натрия 1 атом углерода
- 17. Давайте подведем итог Разобранной тематике, Чтоб каждый без ошибок смог Все формулы внимательно Анализировать, понять И
- 18. 4.Закрепление темы «Формула вещества». Для закрепления теперь Примерчик прорешаем: Два аш-два-эс-о-четыре , Мы всё о ней
- 19. Теперь молекулы считай, Ответ мне правильный давай. - Коэффициент проставлен два. - Соображает голова. Какие атомы
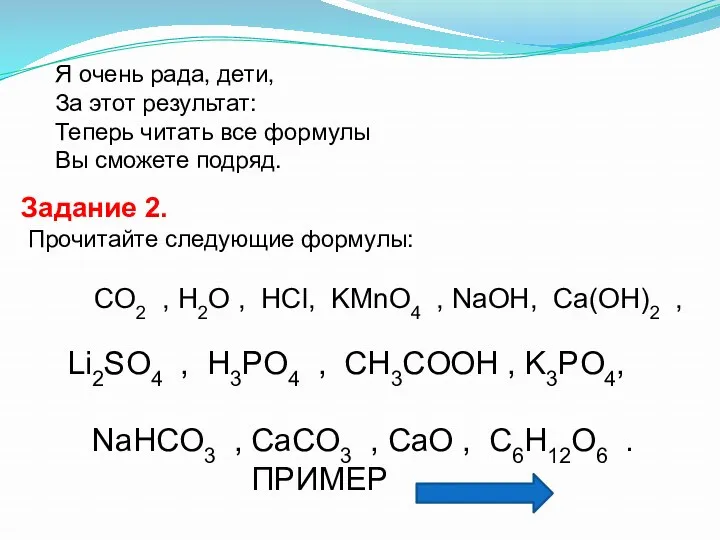
- 20. Я очень рада, дети, За этот результат: Теперь читать все формулы Вы сможете подряд. Задание 2.
- 21. CO2 KМnO4 H3PO4 NaHCO3 C6H12O6 - це-о-два - калий-марганец-о-четыре - аш-три-пэ-о-четыре - натрий-аш-це-о-три - це-шесть-аш-двенадцать-о-шесть
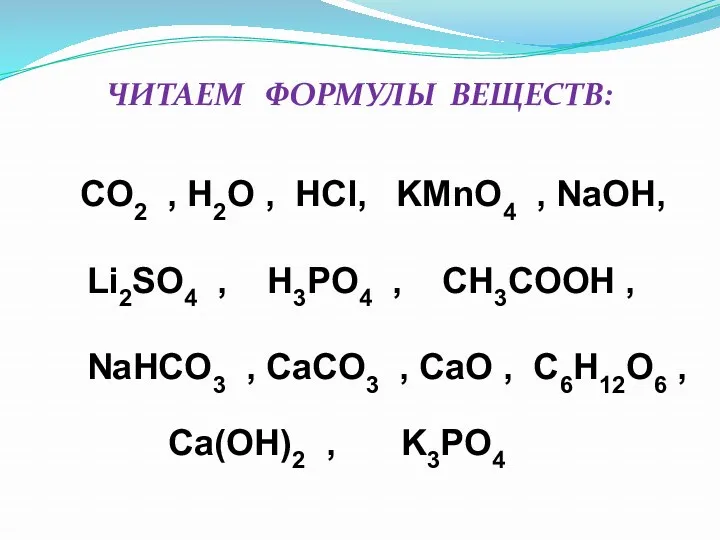
- 22. CO2 , H2O , HCl, KМnO4 , NaOH, Li2SO4 , H3PO4 , CH3COOH , NaHCO3 ,
- 23. 5. «Простые и сложные вещества. Относительная молекулярная масса вещества Все в природе вещества Мы сейчас поделим.
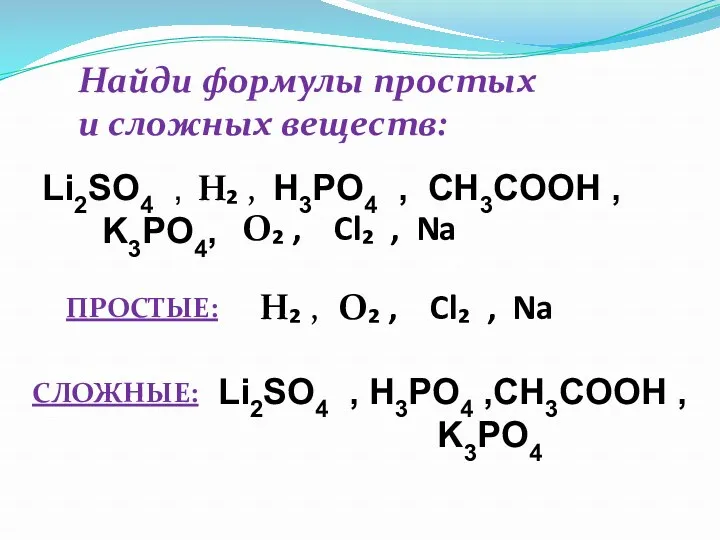
- 24. Найди формулы простых и сложных веществ: Li2SO4 , H3PO4 , CH3COOH , K3PO4, H₂ , O₂
- 25. Масса молекулярная Понятие относительное. Смысл её физический Совсем не удивительный. Массу чтоб молекулы быстренько сравнить, Нужно
- 26. Mr(Na₂O) = 2 · Ar(Na) + Ar(O) = 2 · 23 + 16 = 62 Mr(H₂SO₄)
- 27. 6.Закрепление темы «Простые и сложные вещества. Относительная молекулярная масса вещества». Задание 1. Ниже перечисленные вещества разделите
- 28. 7. Заключительная часть . Ну вот , ребята дорогие, Заканчивается урок. Вы поработали на славу, Трудился
- 29. Ошибку эту я смогу Немедленно исправить. Ну что ж я с вами не прощаюсь, Благодарю всех
- 31. Скачать презентацию



















 Золото
Золото Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Ионные уравнения реакций
Ионные уравнения реакций Нефтепродукты в косметическом производстве. Биологически активные вещества
Нефтепродукты в косметическом производстве. Биологически активные вещества Химические формулы
Химические формулы Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі
Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі Муравьиная кислота
Муравьиная кислота Основания. Определите степени окисления элементов
Основания. Определите степени окисления элементов Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Коллоидная химия
Коллоидная химия Классификация органических соединений. Углеводороды
Классификация органических соединений. Углеводороды Химический элемент: йод
Химический элемент: йод Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization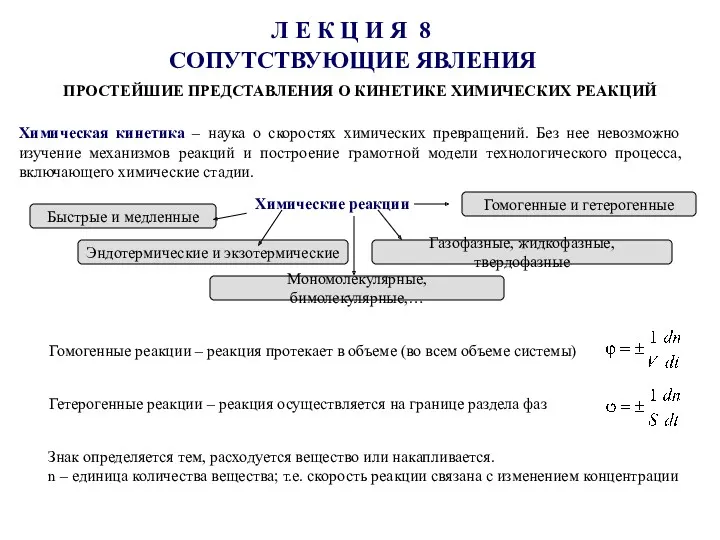 Простейшие представления о кинетике химических реакций
Простейшие представления о кинетике химических реакций Рождение органической химии
Рождение органической химии Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Минералы и горные породы
Минералы и горные породы Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау
Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау Методы получения органических галогенидов
Методы получения органических галогенидов Масса и формулы (8 класс)
Масса и формулы (8 класс) Теоретические основы органической химии
Теоретические основы органической химии