Слайд 2

Валентность элементов
Валентность – это способность атома образовывать химические связи.
Валентность для элементов
бывает постоянная и переменная.
Элементы с постоянной валентностью:
I – H, Li, Na, K, Rb, Cs, Ag
II – O, Be, Mg, Ca, Sr, Ba, Zn
III – B, Al
Слайд 3

Валентность элементов
Алгоритм вычисления валентности элемента
по химической формуле:
Поставить над одним элементом
его постоянную валентность римской цифрой.
Умножить эту постоянную валентность на индекс того же самого элемента. Полученное произведение записать арабской цифрой в кружок.
Разделить полученное произведение на индекс другого элемента. Поставить римской цифрой его валентность.
Слайд 4

Валентность элементов
Оксиды – сложные вещества, состоящие из двух элементов, один из
которых кислород.
Хлориды – сложные вещества, состоящие из двух элементов, один из которых хлор. Хлор находится в химической формуле на втором месте и имеет валентность I.
Сульфиды – сложные вещества, состоящие из двух элементов, один из которых сера. Сера находится в химической формуле на втором месте и имеет валентность II.
Слайд 5

Валентность элементов
PbCl2
BiCl3
CH4
CoO
Mg3N2
SiH4
HBr
NiCl2
Al2S3
CS2
SO3
NH3
FeO
Br2O7
P2O5
H2S
Cu2S
Li3N
FeCl3
SO2
Определите валентности элементов в следующих соединениях:
Слайд 6

Упражнения по теме:
«Определение валентности элементов в бинарных соединениях»
Слайд 7
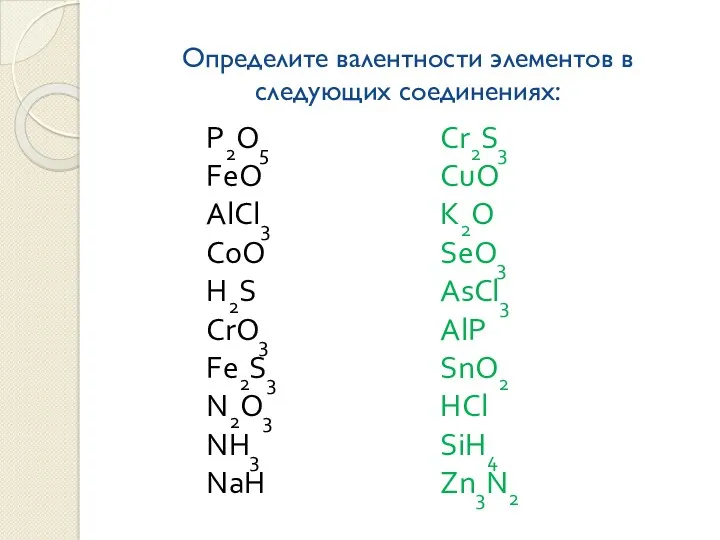
Определите валентности элементов в следующих соединениях:
Слайд 8

Проверочная работа
«Определение валентности элементов в бинарных соединениях»
Слайд 9
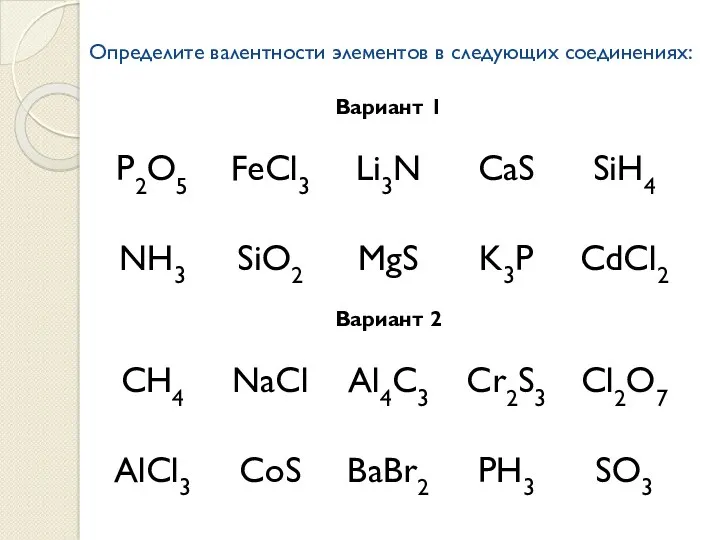
Определите валентности элементов в следующих соединениях:
Слайд 10

Степень окисления элементов
Степень окисления – условный заряд атома элемента, вычисленный из
предположения, что вещество состоит из ионов.
Для вычисления степени окисления элемента следует учитывать следующие положения:
Степени окисления атомов в простых веществах равны нулю. Простыми называются вещества, состоящие из одного элемента.
Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы сложного вещества, всегда равна нулю. Сложными называются вещества, состоящие из нескольких элементов.
Слайд 11

Степень окисления элементов
Постоянную степень окисления имеют атомы: водорода (+1) (исключение гидриды
щелочных и щелочноземельных металлов – NaH-1), кислорода (-2) (исключения: Н2О2-1 (пероксид водорода и его соли), О+2F2 (фторид кислорода).
Степень окисления металлов всегда положительна и численно равна валентности.
Металлы с постоянной валентностью и СО:
+1 – Li, Na, K, Rb, Cs, Ag
+2 – Be, Mg, Ca, Sr, Ba, Zn
+3 – Al
Слайд 12

Степень окисления элементов
Для элементов главных подгрупп положительная степень окисления не может
превышать величину, равную номеру группы периодической системы, а отрицательная степень окисления вычисляется по формуле: номер группы – 8.
Степень окисления элемента в кислотном оксиде, соответствующей кислоте и образующейся соли одинакова.
Слайд 13

Степень окисления элементов
P2O5
Cu
Fe
CuOH
Al(ClO4)3
K2CO3
Co(OH)2
SeO3
H2S
H3AsO3
H2Cr2O7
O2
Na2SO3
Sn(OH)2
N2
HClO4
NH4OH
SiH4
HNO3
Zn(NO3)2
Определите СО каждого элемента в следующих соединениях:
Слайд 14

Al(NO3)3
H2
Mg3N2
NH3
Cu
K2Cr2O7
Cr(OH)3
NH4OH
HClO4
Fe2O3
O3
NO2
H3AsO4
Ca(OH)2
CaSO4
N2
RbNO2
KMnO4
SO3
H2S
Дополнительное задание:
Определите СО каждого элемента в следующих соединениях:
Слайд 15

Проверочная работа
«Определение степени окисления элементов в соединениях»














 Кислоты, их состав и названия
Кислоты, их состав и названия Обмен липидов
Обмен липидов Роль воды в химических реакциях
Роль воды в химических реакциях Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) IV группа главная подгруппа
IV группа главная подгруппа Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток Углерод и его соединения
Углерод и его соединения Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Неметаллические материалы
Неметаллические материалы Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Производство полимеров
Производство полимеров Основания. Неорганические соединения
Основания. Неорганические соединения Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Кислотно-основное титрование
Кислотно-основное титрование Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Автомобильные пластичные смазки
Автомобильные пластичные смазки Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Окислительновосстановительное титрование
Окислительновосстановительное титрование