Содержание
- 3. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Алмаз Прозрачное кристаллическое вещество, очень твердое (эталон твердости) чаще всего бесцветный (бывает синего, голубого,
- 4. Графит Темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском, мягкий, непрозрачный, хорошо проводит тепло и
- 5. Карбин Мелко кристаллический порошок черного цвета, полупроводник, тверже графита, но мягче алмаза Кристаллы состоят из линейных
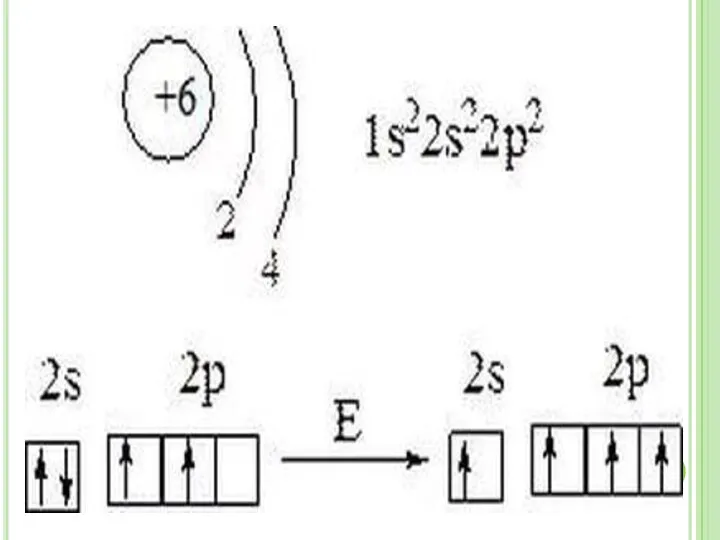
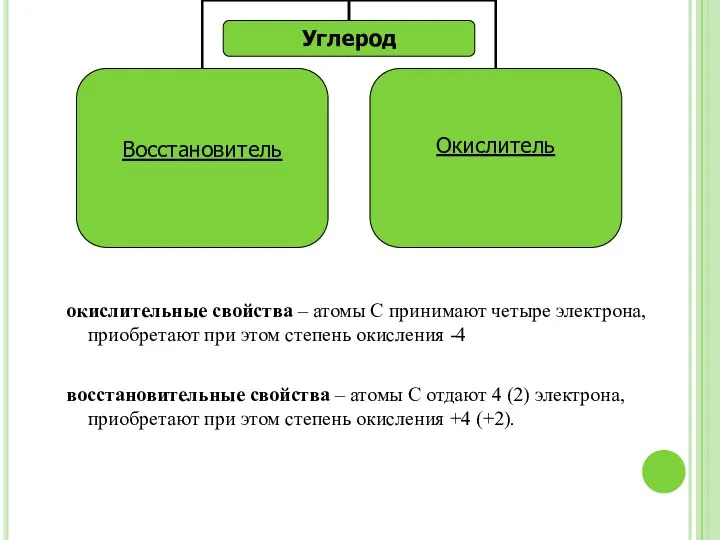
- 6. окислительные свойства – атомы С принимают четыре электрона, приобретают при этом степень окисления -4 восстановительные свойства
- 7. Окислительные свойства 1.При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С
- 8. Восстановительные свойства 1. При нагревании с водяным паром он вытесняет из воды водород: Н2O + С
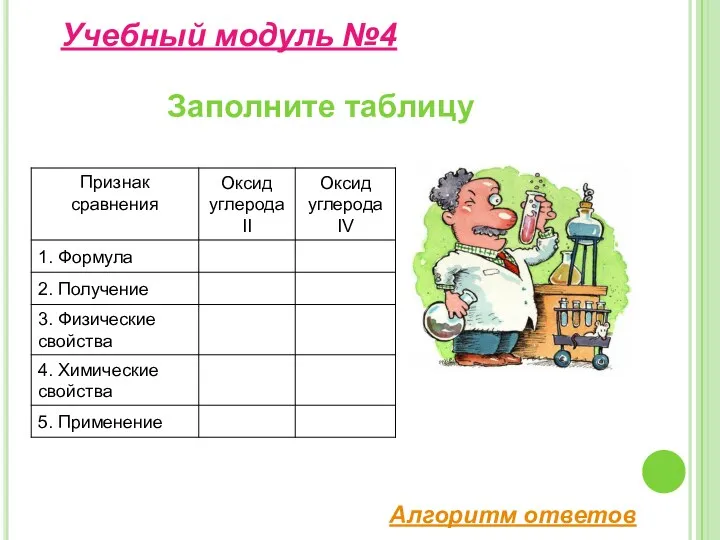
- 9. Заполните таблицу Учебный модуль №4 Алгоритм ответов
- 11. 2CO + O2 = 2CO2 + Q Fe2O3 + 3CO = 2Fe + 3CO2 CO +
- 12. CO2 + H2O = H2CO3 Na2O + CO2 = Na2CO3 Ca(OH)2 + CO2 = CaCO3 +
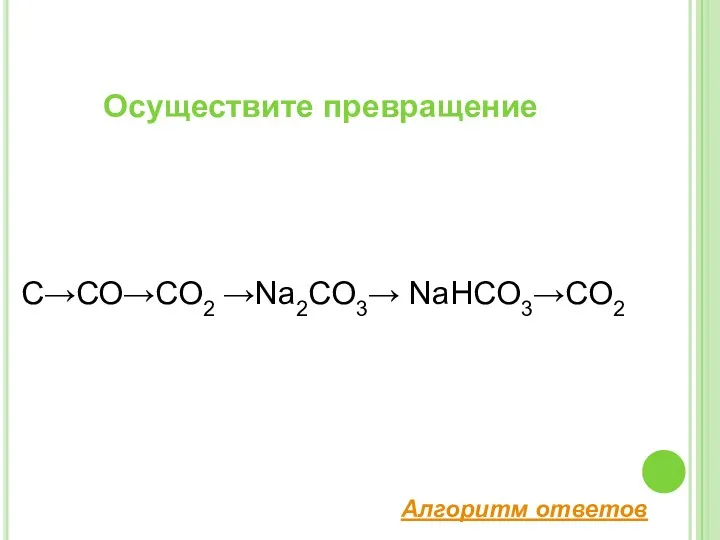
- 14. Осуществите превращение С→СО→СО2 →Na2CO3→ NaHCO3→CO2 Алгоритм ответов
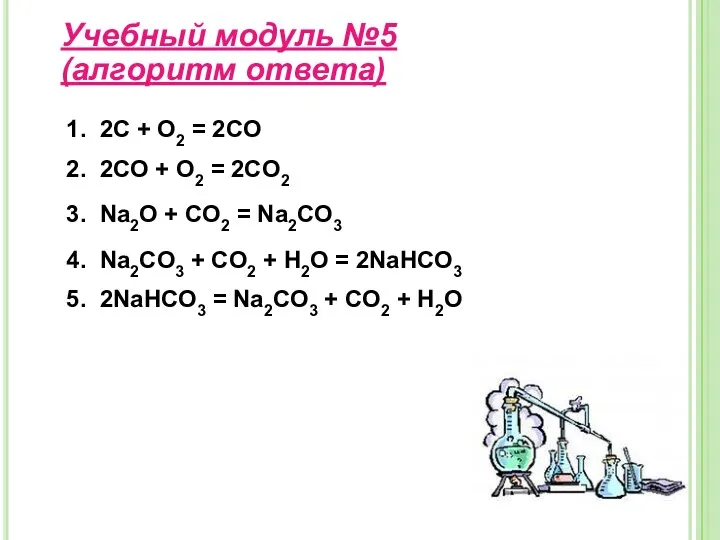
- 15. Учебный модуль №5 (алгоритм ответа) 1. 2С + О2 = 2СО 2. 2CO + O2 =
- 17. Скачать презентацию









 Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Элементы IV А - группы
Элементы IV А - группы Халькогены
Халькогены Складні білки
Складні білки Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Химические и физические явления в жизни человека
Химические и физические явления в жизни человека Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет Значение пищи и ее состав
Значение пищи и ее состав Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Соединения железа
Соединения железа Нұсқа талдау
Нұсқа талдау Основы фармацевтической химии
Основы фармацевтической химии Водород. Н2
Водород. Н2 Гидроксид аммония
Гидроксид аммония Кислоты. Состав кислот
Кислоты. Состав кислот Preparation for COP
Preparation for COP ВОДОРОД
ВОДОРОД Получение и применение алканов
Получение и применение алканов Аммиак
Аммиак Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Свойства фосфора
Свойства фосфора Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Фенолдар, аминдер, альдегидтер
Фенолдар, аминдер, альдегидтер Железо. Нахождение в природе. Свойства железа
Железо. Нахождение в природе. Свойства железа