Содержание
- 2. Задачи урока: актуализировать знания учащихся по теме: “Строение атома”; организовать коллективную работу учащихся от постановки учебной
- 3. Железо 4 период VIII группа побочная подгруппа
- 4. Природные соединения железа магнетит(магнитный железняк) Fe3O4 (Fe2O3 · FeO) - содержит до 72% железа; - важнейшие
- 5. - содержит до 65% железа; - важнейшие месторождения в России – Северный Урал, Восточное Забайкалье; -
- 6. Природные соединения железа (бурый железняк) Fe2O3 · n H2O - содержит до 60% железа; - важнейшие
- 7. Природные соединения железа Пирит (железный или серный колчедан)
- 8. Физические свойства железа - серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей
- 9. Химические свойства железа Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два
- 10. Химические свойства железа 1.На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2 =
- 11. Химические свойства железа 3. Взаимодействие с простыми веществами: 3.1 Горит в кислороде 3 Fe + 2
- 12. Химические свойства железа 4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа:
- 13. Химические свойства железа 5. Взаимодействие с разбавленными растворами кислот Fe + 2HCl = FeCl2 + H2
- 14. Задания для закрепления Составьте уравнения реакций получения железа из его оксидов Fe2O3 и Fe3O4 , используя
- 16. Скачать презентацию













 Анализ проб воды
Анализ проб воды Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Химические свойства и получение алканов
Химические свойства и получение алканов Олово и свинец
Олово и свинец Күкірт қышқылы
Күкірт қышқылы Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Жуғыш заттар және жуғыш әсері. 2 Лекция
Жуғыш заттар және жуғыш әсері. 2 Лекция Кристаллы и минералы
Кристаллы и минералы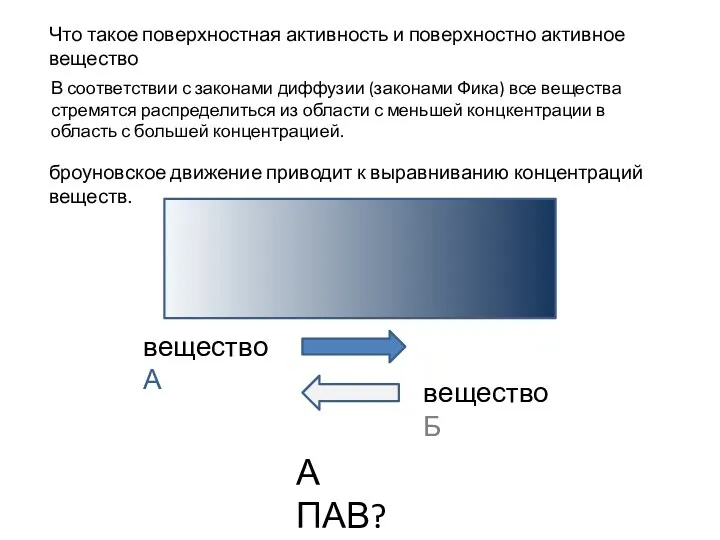 Поверхностная активность и поверхностно активное вещество
Поверхностная активность и поверхностно активное вещество Строение и свойства циклоалканов
Строение и свойства циклоалканов Химические реакции или химические явления
Химические реакции или химические явления Растворы ВМС
Растворы ВМС Констукционные и функциональные волокнистые композиты. Стекловолокно
Констукционные и функциональные волокнистые композиты. Стекловолокно Основные способы получения металлов
Основные способы получения металлов Расчет распределения пор по размерам из изотерм адсорбции
Расчет распределения пор по размерам из изотерм адсорбции Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас
Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас Установка гидрокрекинга
Установка гидрокрекинга Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Особенности лантаноидов и актиноидов
Особенности лантаноидов и актиноидов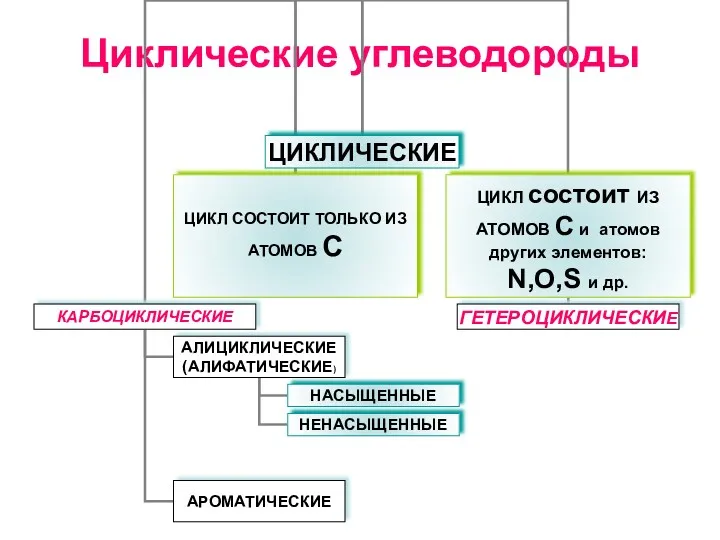 Циклические углеводороды
Циклические углеводороды Полимеры
Полимеры Кристаллические решетки
Кристаллические решетки Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Соли, их классификация и свойства
Соли, их классификация и свойства Молярная масса вещества
Молярная масса вещества