Содержание
- 2. ПЛАН 18.1 Общая характеристика ВМС 18.2 Набухание и растворение ВМС 18.3 Полиэлектролиты 18.4 Коллоидная защита
- 3. 18.1 Высокомолекулярными соединениями (ВМС) называют вещества, имеющие молекулярную массу от 10 тысяч до нескольких миллионов. Длина
- 4. К природным ВМС (биополимерам) относятся крахмал, целлюлоза, декстраны, нуклеиновые кислоты, белки, натуральные каучуки.
- 5. Cинтетические полимеры являются продуктами реакций полимеризации и поликонденсации.
- 6. Реакции полимеризации Полиэтилен n CH2=CH2 → [–CH2–CH2–]n Применение: пленки, трубы, флаконы, бутылочки.
- 7. 2) Тефлон nCF2=CF2 → [–CF2–CF2–]n Применение: протезы сердечного клапана и кровеносных сосудов.
- 8. Реакции поликонденсации Найлон-продукт поликонденсации адипиновой кислоты с гексаметилендиамином; используется для получения искусственных волокон и шовного материала
- 9. n HOOC-(CH2)4-COOH + n H2N–(CH2)6–NH2 [-CO-(CH2)4-CO-NH-(CH2)6-NH-]n + H2O Получение найлона
- 10. Классификация ВМС 1.По конфигурации цепи а) линейные желатин, натуральный каучук
- 11. б) разветвленные крахмал, гликоген
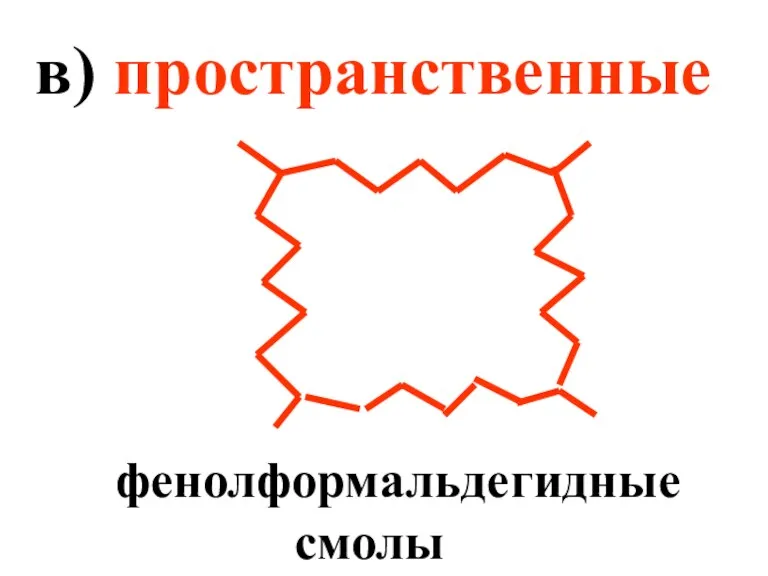
- 12. в) пространственные фенолформальдегидные смолы
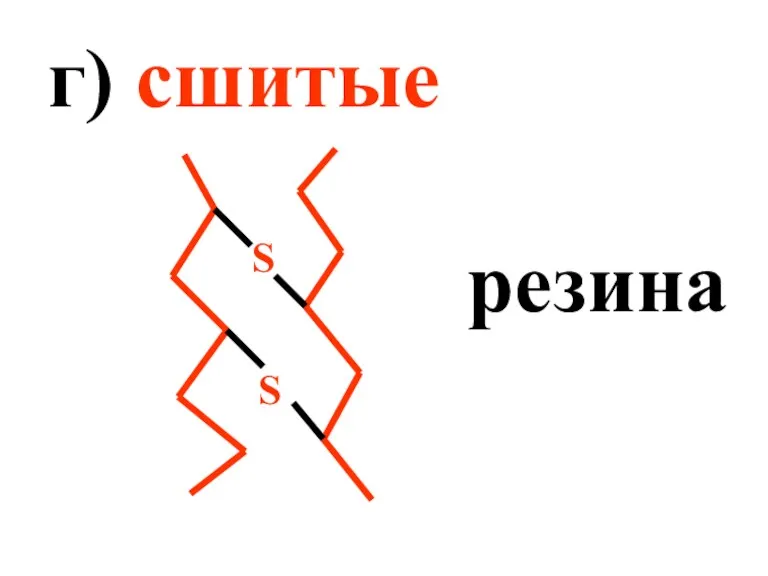
- 13. г) сшитые резина S S
- 14. 2. По элементному составу: Гомоцепные ВМС полимерные цепи состоят только из атомов углерода; их получают реакцией
- 15. Гетероцепные ВМС содержат в цепи не только углерод, но и гетероатомы (N, S и др.); их
- 16. 3. По значению молярной массы Монодисперсные ВМС состоят из молекул, имеющих одинаковую молярную массу (гемоглобин и
- 17. Полидисперсные ВМС состоят из молекул различной массы (ДНК, фибриллярные белки, каучуки). Для них рассчитывается среднеарифметическая молярная
- 18. Специфическими свойствами полимеров являются: Гибкость цепей, Наличие прочных межмолекулярных связей
- 19. 18.2 ВМС могут образовывать как истинные, так и коллоидные растворы.
- 20. Истинные растворы образуются при растворении полярного полимера в полярном растворителе (белок в воде) или неполярного полимера
- 21. Растворению полимеров предшествует их набухание.
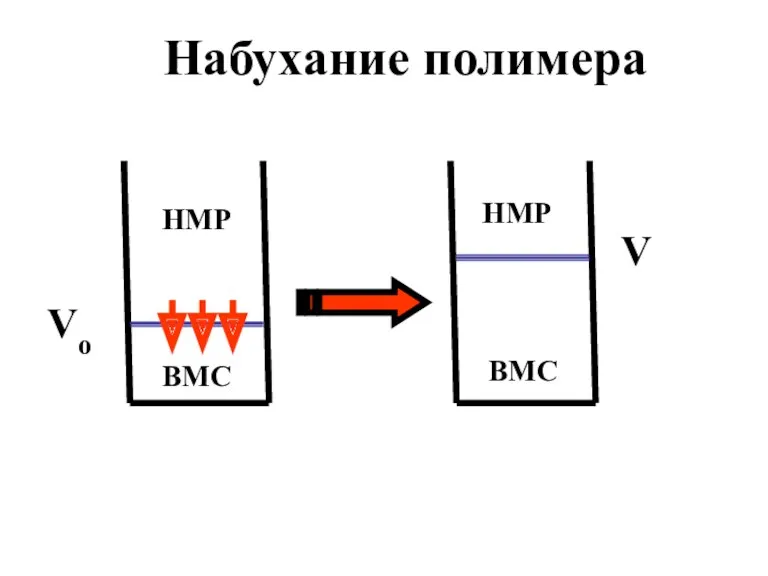
- 22. Набухание ВМС – это увеличение объема и массы полимера вследствие односторонней диффузии низкомолекулярного растворителя в высокомолекулярное
- 23. Диффузия молекул ВМС в растворитель не протекает из-за их низкой подвижности, обусловленной большой молярной массой и
- 24. НМР ВМС ВМС НМР Набухание полимера Vo V
- 25. Мерой набухания служит степень набухания полимера (α): α = V - Vo Vo где Vo и
- 26. α = m - mo mo где mo и m – начальная и конечная масса полимера
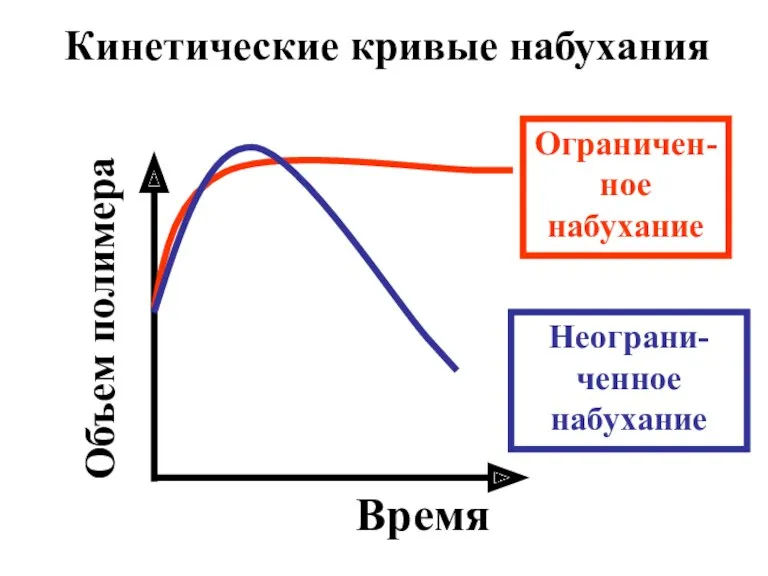
- 27. Набухание Неогра- ниченное Ограни-ченное
- 28. Ограниченное набухание (желатин в холодной воде) приводит к образованию геля. Гель –это состояние вещества, являющееся промежуточным
- 29. Неограниченное набухание (желатин в горячей воде) завершается образованием истинного раствора.
- 30. Время Объем полимера Кинетические кривые набухания Ограничен-ное набухание Неограни-ченное набухание
- 31. На процесс набухания влияет: Природа ВМС и растворителя: «Подобное растворяется в подобном»
- 32. 2) Конфигурация цепи полимера; линейные и разветвленные ВМС лучше набухают, чем пространственные и сшитые; 3) Кислотность
- 33. 4) Температура: при нагревании увеличивается степень набухания, так как возрастает скорость диффузии низкомолекулярного растворителя в полимер.
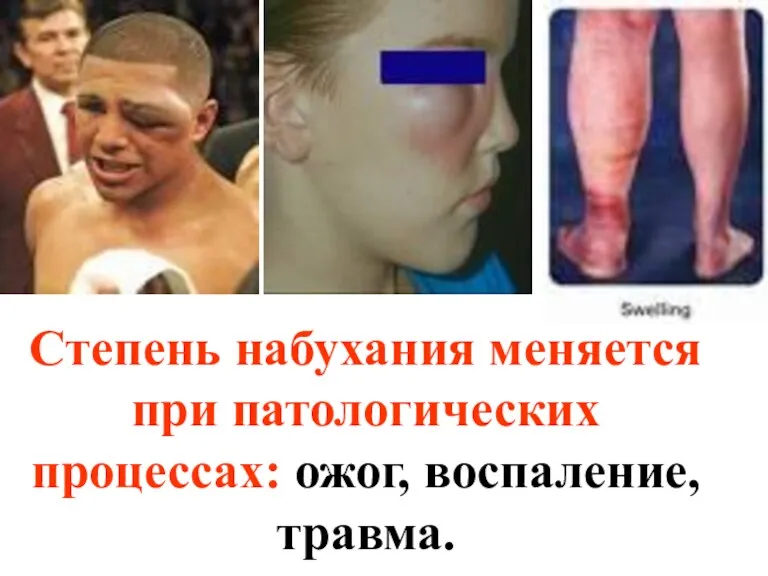
- 34. В механизме физиологических процессов набухание играет большую роль: рост организма, сокращение мышц, тканевый обмен.
- 35. К набуханию способны кожа, ткани мозга, стекловидное тело глаза.
- 36. Степень набухания меняется при патологических процессах: ожог, воспаление, травма.
- 37. Старение человека сопровождается уменьшением способности тканей организма к набуханию.
- 38. Растворы ВМС и коллоидные растворы существенно отличаются друг от друга, однако существует и некоторая общность их
- 42. 18.3 Полиэлектролиты – это ВМС, содержащие ионогенные группы. По характеру ионогенных групп полимеры делятся на три
- 43. 1.Полиэлектролиты кислотного типа – СООН ⇄ – COO- + H+ – SO3Н ⇄ – SO3- +
- 44. 2. Полиэлектролиты основного типа –NH2 + H+ ⇄ – NH3+
- 45. 3. Амфотерные полиэлектролиты (полиамфолиты) – это ВМС, содержащие и кислотные, и основные группы. Важнейшие из них
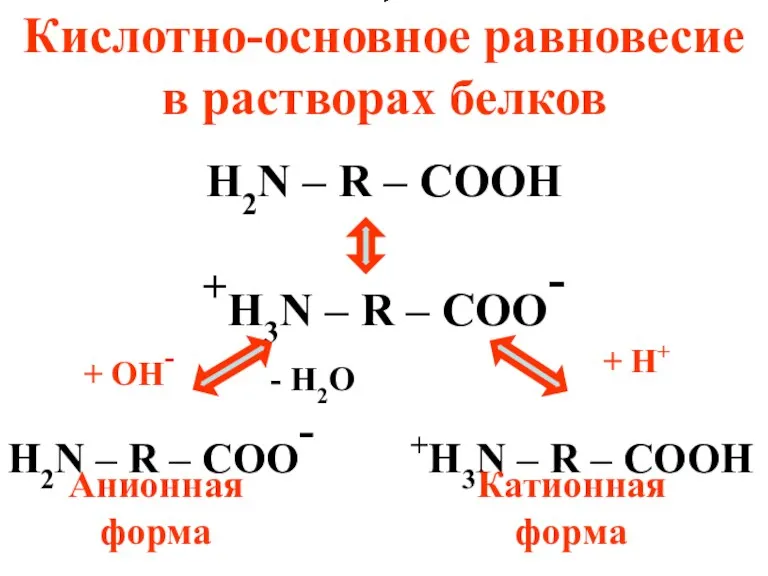
- 46. Кислотно-основное равновесие в растворах белков H2N – R – COOH +H3N – R – COO- H2N
- 47. Особым состоянием белка является его изоэлектрическое состояние, в котором суммарный заряд белковой молекулы равен нулю. Упрощенно
- 48. Изоэлектрическая точка (ИЭТ или pI)– это значение рН раствора, при котором полиамфолит находится в изоэлектрическом состоянии.
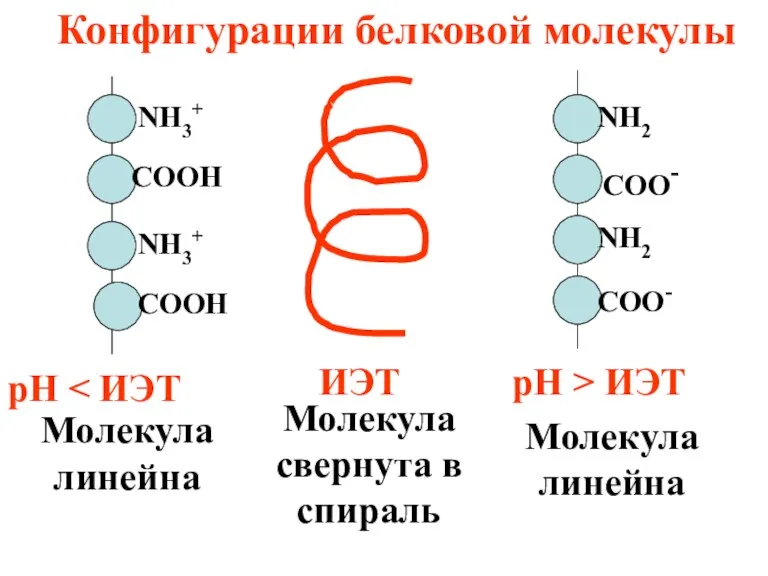
- 49. В ИЭТ белки имеют специфические свойства, что объясняется особой конфигурацией их молекул.
- 50. ИЭТ Молекула свернута в спираль Конфигурации белковой молекулы рН рН > ИЭТ Молекула линейна Молекула линейна
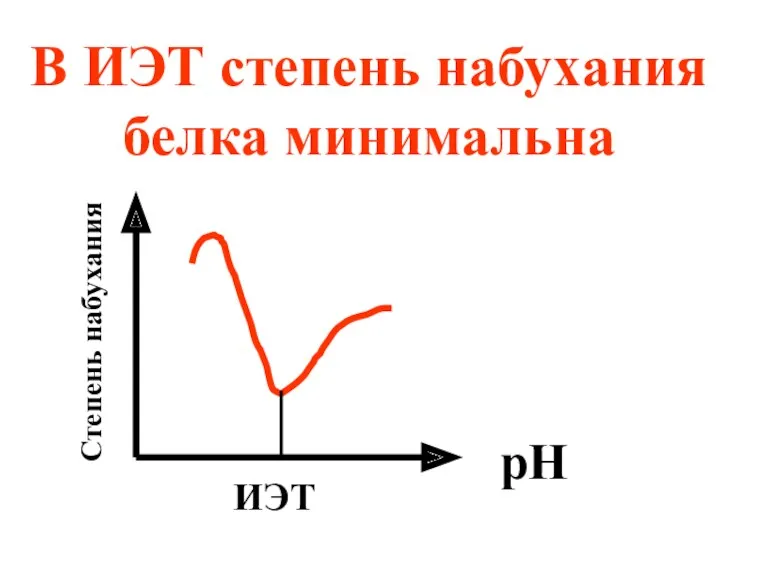
- 51. Методы экспериментального определения ИЭТ белков 1) Путем измерения степени набухания белков в растворах с различной кислотностью.
- 52. В ИЭТ степень набухания белка минимальна ИЭТ рН Степень набухания
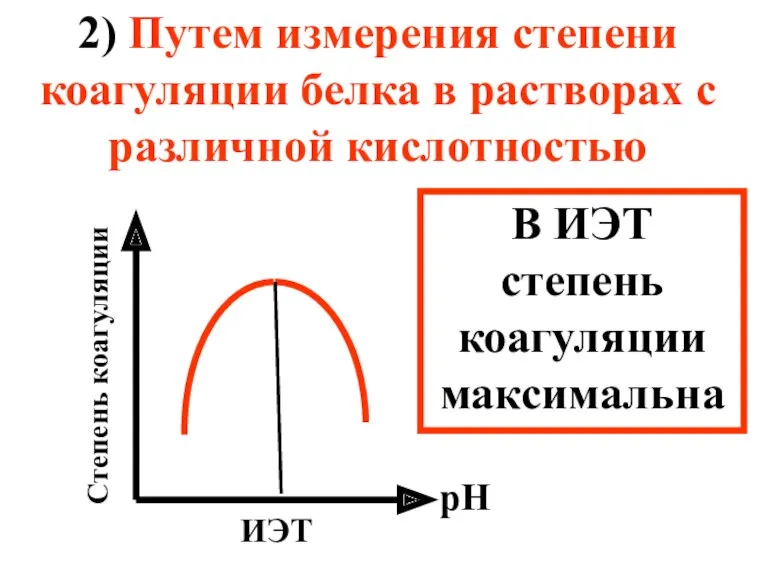
- 53. 2) Путем измерения степени коагуляции белка в растворах с различной кислотностью рН Степень коагуляции ИЭТ В
- 54. Важнейшими факторами, вызывающими коагуляцию белка и других ВМС являются: добавление электролитов (высаливание), добавление нерастворителей – жидкостей,
- 55. Коагулирующее действие как электролитов, так и нерастворителей обусловлено их десольватирующем действием; они связывают молекулы растворителя, уменьшая
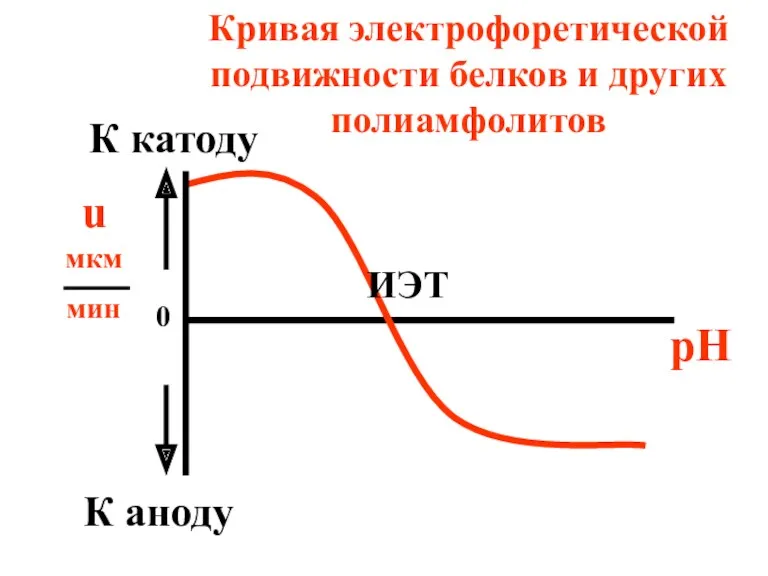
- 56. 3) Путем измерения электрофоретической подвижности белков (u) в растворах с различной кислотностью В ИЭТ электрофоретическая подвижность
- 57. Кривая электрофоретической подвижности белков и других полиамфолитов u мкм мин pH ИЭТ 0 К аноду К
- 58. Электрофорез используют не только для определения ИЭТ, но и для разделения смесей белков на фракции.
- 59. 18.4 Коллоидная защита - это повышение порога коагуляции гидрофобных золей в присутствии ВМС и ПАВ.
- 60. Механизм защитного действия Молекулы ВМС адсорбируются на поверхности частиц дисперсной фазы в результате чего их поверхность
- 61. Мерой защитного действия ВМС является «золотое» число - минимальная масса (мг) сухого полимера, необходимая для защиты
- 62. желатин 0,008 гемоглобин 0,05 казеин 0,01 крахмал 25 Золотые числа некоторых полимеров (мг)
- 63. Измерение «золотого» числа спинномозговой жидкости используется как важный диагностический тест; оно существенно отличается от нормы при
- 64. Кроме «золотых», для количественной оценки защитного действия ВМС используют «рубиновые», «серебряные», «железные» и другие числа.
- 65. Коллоидная защита играет важную роль в жизнедеятельности организма. Белки крови стабилизируют дисперсии жиров, холестерина и малорастворимых
- 66. При пониженной защитной функции белков возникает целый ряд заболеваний: подагра, атеросклероз, кальциноз, образование почечных и печеночных
- 67. Способность крови удерживать в растворенном состоянии большое количество газов (О2 и СО2) также обусловлена защитным действием
- 68. В фармацевтической промышленности защитные свойства ВМС используются для получения концентрированных золей серебра, ртути, золота и их
- 69. Например, лекарственный препарат колларгол – это коллоидный раствор, содержащий 70% высокодисперсного металлического серебра, стабилизированного гидролизатами белков.
- 71. Скачать презентацию




![Реакции полимеризации Полиэтилен n CH2=CH2 → [–CH2–CH2–]n Применение: пленки, трубы, флаконы, бутылочки.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/435063/slide-5.jpg)
![2) Тефлон nCF2=CF2 → [–CF2–CF2–]n Применение: протезы сердечного клапана и кровеносных сосудов.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/435063/slide-6.jpg)

![n HOOC-(CH2)4-COOH + n H2N–(CH2)6–NH2 [-CO-(CH2)4-CO-NH-(CH2)6-NH-]n + H2O Получение найлона](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/435063/slide-8.jpg)




























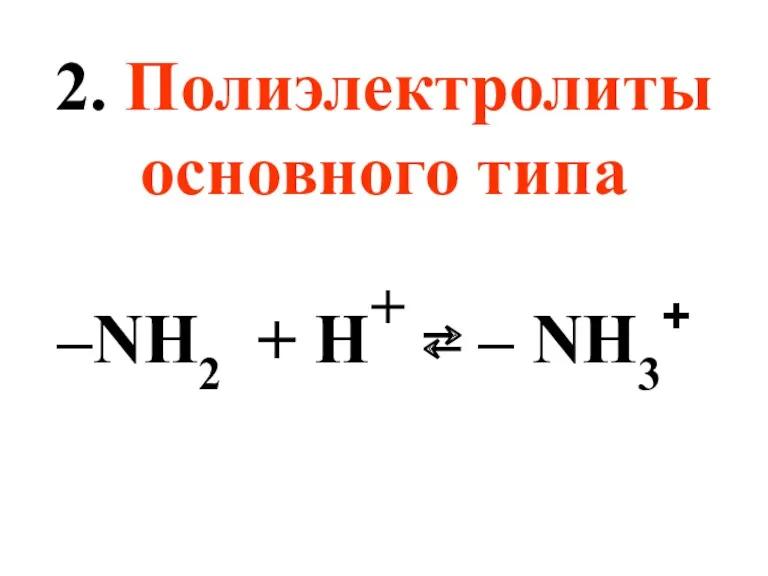




















 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН