Содержание
- 2. 1. Простые вещества, газы, оксиды, нерастворимые соединения не диссоциируют (в ионных уравнениях их записывают в молекулярном
- 3. 2. Малорастворимые вещества в левой части уравнения записывают в виде ионов, а в правой части –
- 4. 3. Общая сумма зарядов ионов в левой части уравнения должна быть равна общей сумме зарядов ионов
- 5. 4. Реакции ионного обмена идут до конца, если образуется: а) осадок (↓); б) газ (↑); в)
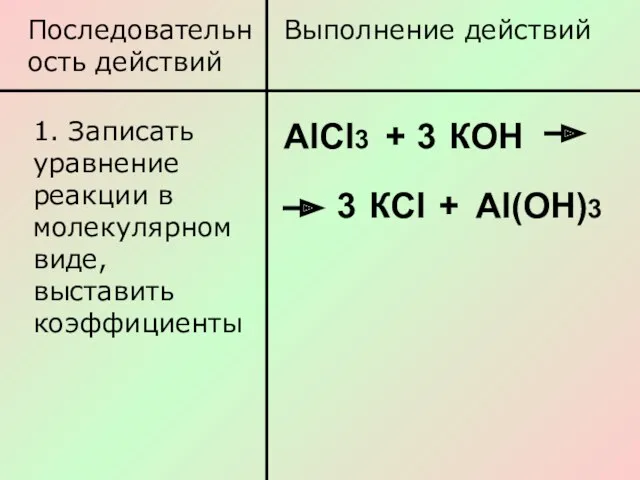
- 6. Последовательность действий Выполнение действий 1. Записать уравнение реакции в молекулярном виде, выставить коэффициенты АlСl3 + 3
- 7. Последовательность действий Выполнение действий 2. Используя таблицу растворимости определить растворимость каждого вещества АlСl3 – р. КСl
- 8. Последовательность действий Выполнение действий 3. Составить полное ионное уравнение, записав электролиты в виде ионов, неэлектролиты в
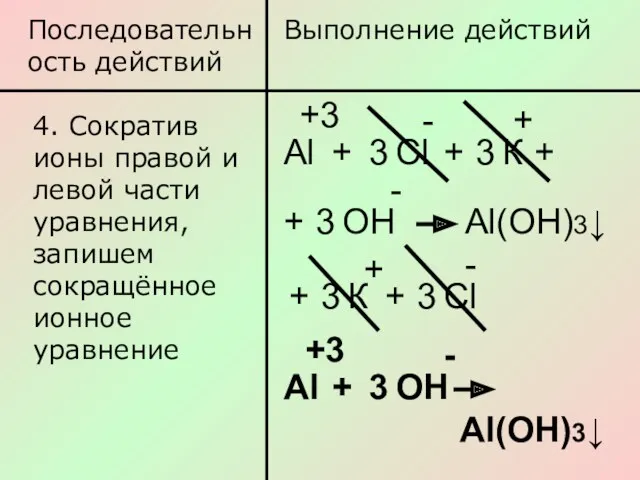
- 9. Последовательность действий Выполнение действий 4. Сократив ионы правой и левой части уравнения, запишем сокращённое ионное уравнение
- 10. Реакций, характеризующих общие химические свойства кислот. 1. Кислоты взаимодействуют с металлами, расположенных в ряду электрохимического ряда
- 11. Последовательность действий Выполнение действий 1. Молекулярное уравнение Zn + Н2SО4 ZnSО4 + Н2 2. Полное ионное
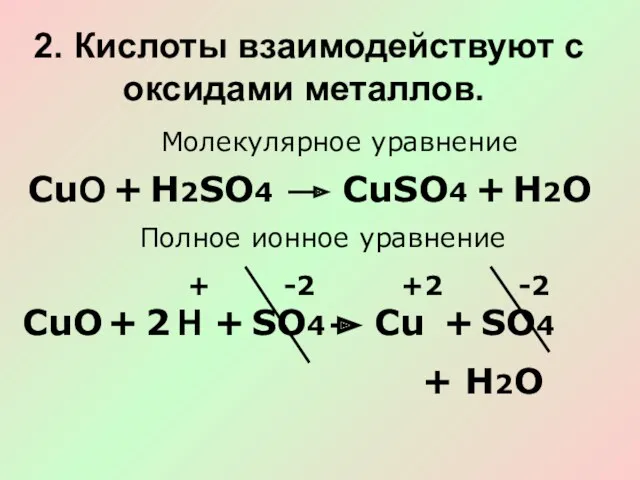
- 12. 2. Кислоты взаимодействуют с оксидами металлов. Молекулярное уравнение СuO + Н2О Н2SО4 CuSО4 + Полное ионное
- 13. Сокращённое ионное уравнение CuО + H Cu + H2O + +2 2 3. Кислоты взаимодействуют с
- 14. H2SO4 + KOH K2SO4 + 2 H2O 2 SO4 + K K + 2 H2O 2
- 15. SO4 H Cu(OH)2 + + + + -2 -2 +2 2 2 SO4 Cu + H2O
- 16. H2SO4 + BaCl2 + BaSO4 HCl ↓ 2 SO4 + Ba + BaSO4 Cl ↓ 2
- 17. H2SO4 + K2CO3 K2SO4 + H2CO3 CO2 + H2O + H + K K + CO2
- 18. Задания для самоконтроля 1. Напишите молекулярные, ионное и сокращенные ионные уравнения реакций между растворами: а) серной
- 20. Скачать презентацию









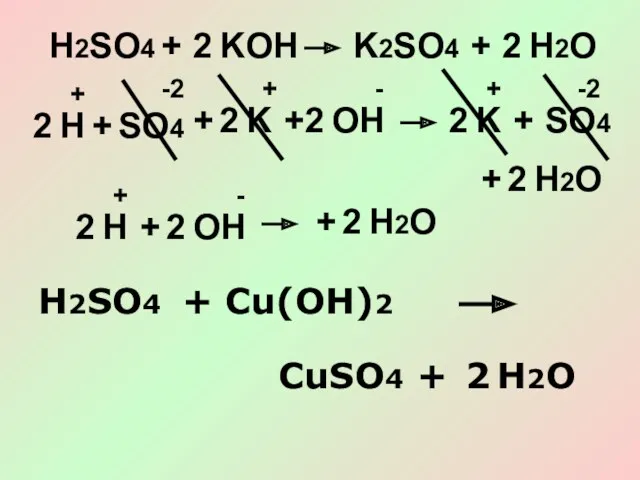

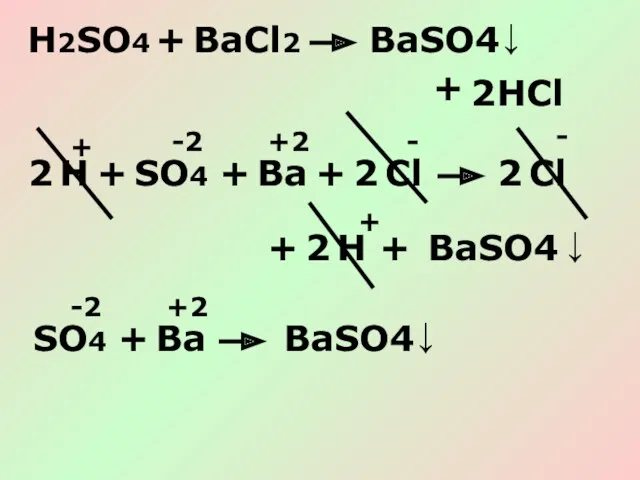
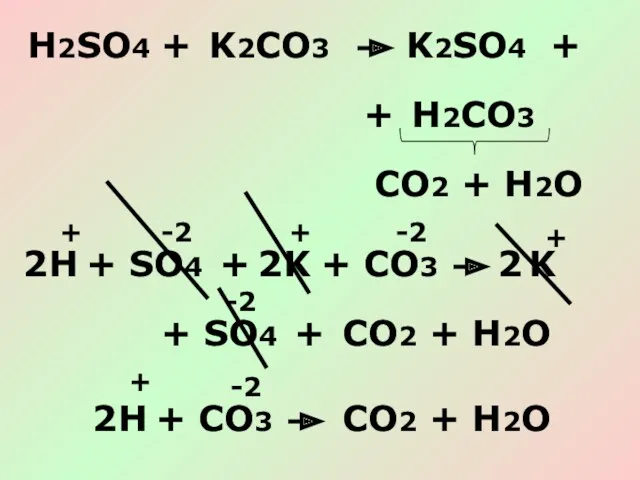

 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Синтетические топлива
Синтетические топлива Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Искусственная и синтетическая резина
Искусственная и синтетическая резина Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены (солеобразующие)
Галогены (солеобразующие) Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Свойства воды. Оценка качества
Свойства воды. Оценка качества Теплота сгорания топлива
Теплота сгорания топлива Железо и его соединения
Железо и его соединения Коррозия металлов
Коррозия металлов Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Анионы. Группы анионов
Анионы. Группы анионов Электронное строение атома
Электронное строение атома Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Магний (Mg)
Магний (Mg) Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Удивительный мир камня
Удивительный мир камня Щелочные металлы
Щелочные металлы Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)