Содержание
- 2. Водородный показатель рН Вода представляет собой очень слабый электролит, и реакция диссоциации воды по уравнению Н2О
- 3. Степень диссоциации воды очень мала, и концентрация недиссоциированных молекул воды практически равна общей концентрации воды, т.е.
- 4. Полученное уравнение показывает, что для воды и разбавленных водных растворов произведение концентраций ионов водорода и гидроксид-ионов
- 5. На практике реакцию среды (кислотность среды) принято выражать как концентрацию ионов водорода, Н+. Чтобы избежать неудобств,
- 6. Для многих явлений и процессов – и в природе, и в технике – роль рН исключительно
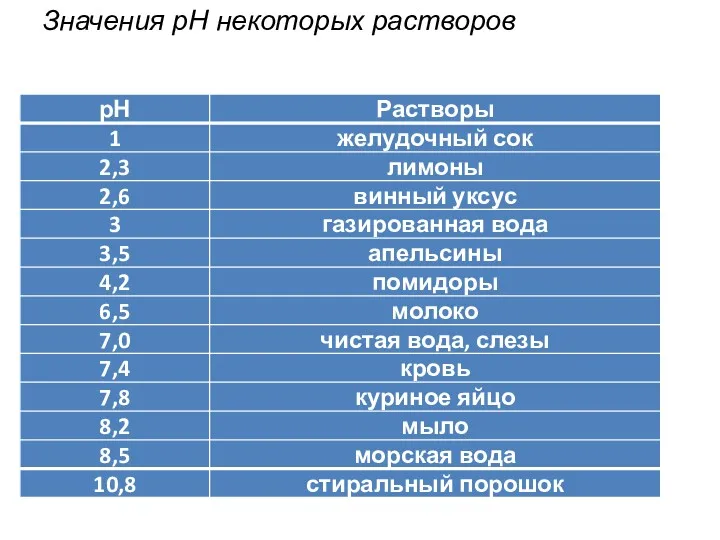
- 7. Значения рН некоторых растворов
- 8. Пример 1. Для 0,01 М раствора гидроксида натрия рассчитайте концентрацию ионов водорода H+, рН, рOН раствора.
- 9. Решение. К рассматриваемому раствору 0,01 (10−2) моль/л NаOH применимы 3 соотношения: Ионное произведение воды Кв =
- 10. Водные растворы электролитов в зависимости от реакции среды при добавлении индикаторов приобретают определенную окраску. Окраска важнейших
- 11. Пример 2. Определить концентрацию ионов водорода (H+) в растворе, рН которого равен 4,60. Решение. Согласно условию
- 13. Реакции солей в растворе. Гидролиз солей Соль можно определить как соединение, которое образуется в результате реакции
- 14. Существует четыре типа гидролиза солей. Соль, образованная слабой кислотой и сильным гидроксидом (основанием). Запишем молекулярное уравнение
- 15. Карбонат натрия Na2СО3, соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO32−,
- 16. 2. Соль, образованная слабым гидроксидом и сильной кислотой. Примерами таких солей могут служить: хлорид аммония NH4Cl,
- 17. Если в состав соли входит многозарядный ион металла, то образуются основные соли: AlBr3 + HOH ⇄
- 18. 3. Соль, образованная слабым гидроксидом и слабой кислотой. К такому типу солей относятся ацетат аммония CH3COONH4,
- 19. 4. Соль, образованная сильным гидроксидом и сильной кислотой. К этому типу солей относятся хлорид натрия NaCl
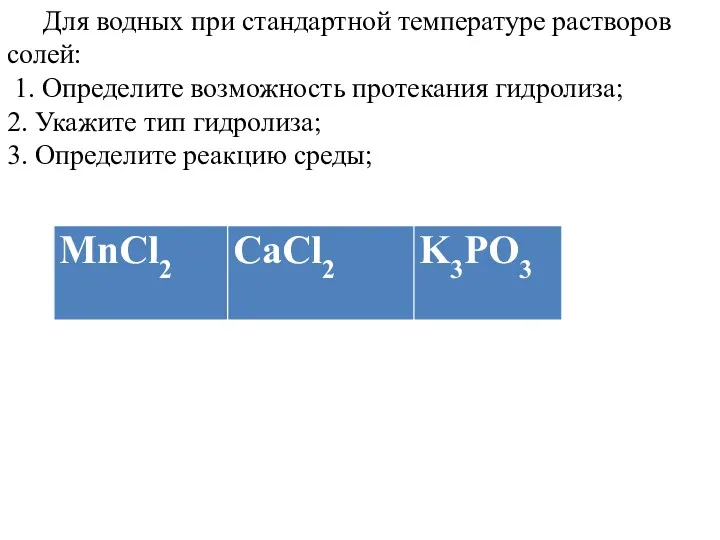
- 20. Для водных при стандартной температуре растворов солей: 1. Определите возможность протекания гидролиза; 2. Укажите тип гидролиза;
- 22. Скачать презентацию












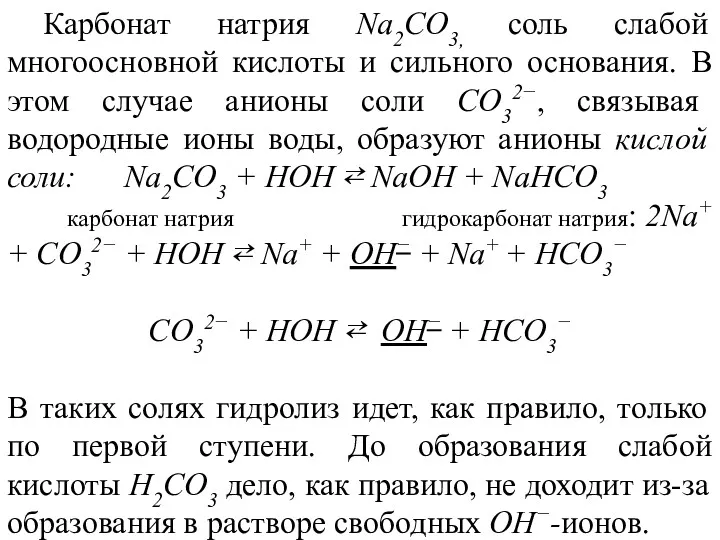




 Хімічне виробництво сталі
Хімічне виробництво сталі Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Химия в искусстве
Химия в искусстве Соли
Соли Кислородсодержащие соединения серы. Оксиды, кислоты, соли
Кислородсодержащие соединения серы. Оксиды, кислоты, соли Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Своя игра по химии
Своя игра по химии Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Золото. История открытия
Золото. История открытия Сера и её соединения
Сера и её соединения Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Рецепты литературы в химических опытах
Рецепты литературы в химических опытах Нуклеиновые кислоты
Нуклеиновые кислоты Горение топлива
Горение топлива Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Гравиметрический метод анализа
Гравиметрический метод анализа Растворы ВМС
Растворы ВМС Основы коррозии и защиты металлов. Химическая коррозия
Основы коррозии и защиты металлов. Химическая коррозия Алюминий және оның қосылыстары
Алюминий және оның қосылыстары АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері алкадиены
алкадиены Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение
Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение Транспортное обеспечение внесения удобрений
Транспортное обеспечение внесения удобрений Щелочные металлы
Щелочные металлы 20230816_belki_2
20230816_belki_2 Электроотрицательность. Степень окисления. Валентность
Электроотрицательность. Степень окисления. Валентность Основные понятия органической химии. Лекция № 1
Основные понятия органической химии. Лекция № 1