Содержание
- 2. Н2О Мr(Н2О)=18 Физические свойства Нахождение в природе Химические свойства Применение
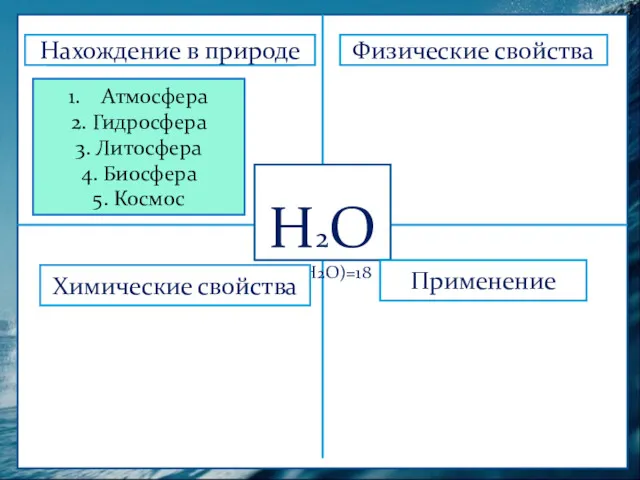
- 3. Н2О Мr(Н2О)=18 Физические свойства Нахождение в природе Химические свойства Применение Атмосфера 2. Гидросфера 3. Литосфера 4.
- 4. Физические свойства Нахождение в природе Химические свойства Применение Атмосфера 2. Гидросфера 3. Литосфера 4. Биосфера 5.
- 5. 1) Реакции разложения: Электролиз воды: 2 H2O ϟ 2H2 + O2
- 6. Реакции соединения: А) С оксидами металлов: С оксидами щелочных металлов ( Li , K, Na); C
- 7. Реакции соединения: А) С оксидами металлов: С оксидами щелочных металлов ( Li , K, Na); C
- 8. Реакции соединения: Б) С оксидами неметаллов: НеМеО + Н2О → Нn(КО)-n (кислородсодержащая кислота) N2O3 + H2O
- 9. Правило: Вода реагирует с оксидами металлов и оксидами неметаллов в том случае, если образуется растворимый гидроксид
- 10. Реакции замещения: Щелочные и щелочноземельные металлы реагируют с водой по схеме: Me + H2O → Me+n(OH)n+
- 11. Реакции обмена: Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al2S3 + HOH
- 12. Реакции обмена: Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al2S3 + HOH
- 13. Реакции обмена: Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al2S3 + HOH
- 14. Реакции обмена: Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al2S3 + 6HOH
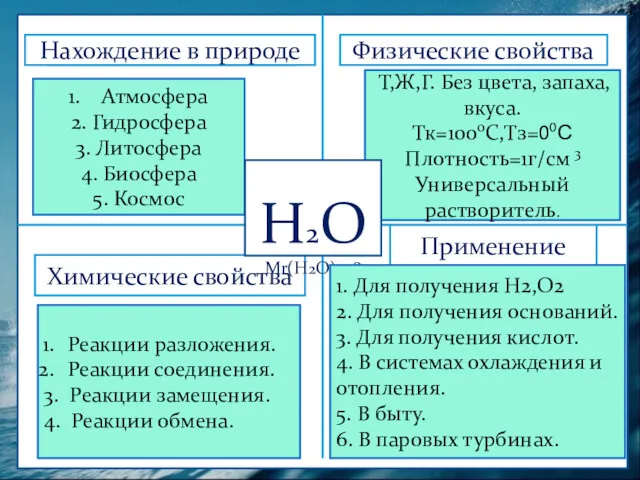
- 15. Физические свойства Нахождение в природе Химические свойства Применение Атмосфера 2. Гидросфера 3. Литосфера 4. Биосфера 5.
- 16. Вариант № 1 1) 2) Напишите уравнение реакции взаимодействия кальция с кислородом и водой. 3) Вариант
- 18. Скачать презентацию












 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)