Содержание
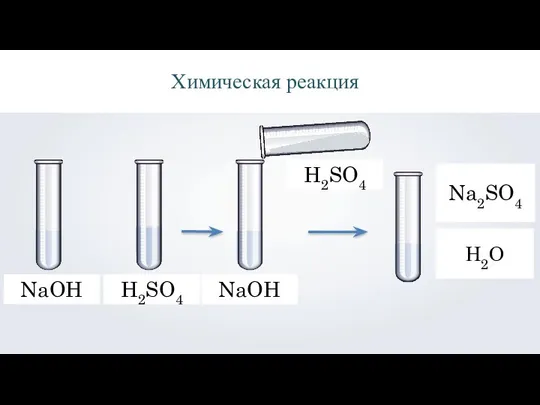
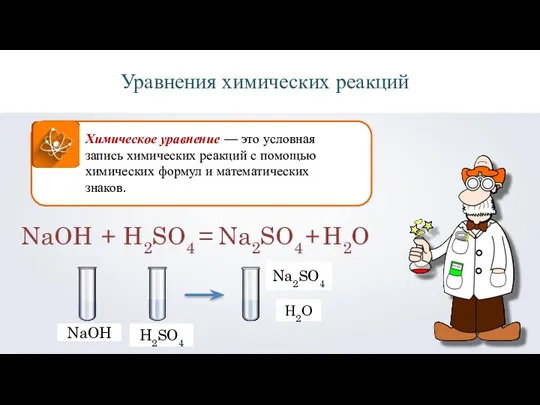
- 2. NaOH H2SO4 Na2SO4 H2SO4 NaOH Химическая реакция Н2О
- 3. Закон сохранения массы веществ М.В. Ломоносов Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся
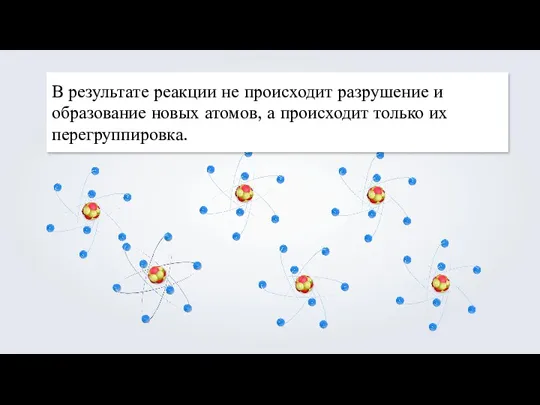
- 4. В результате реакции не происходит разрушение и образование новых атомов, а происходит только их перегруппировка.
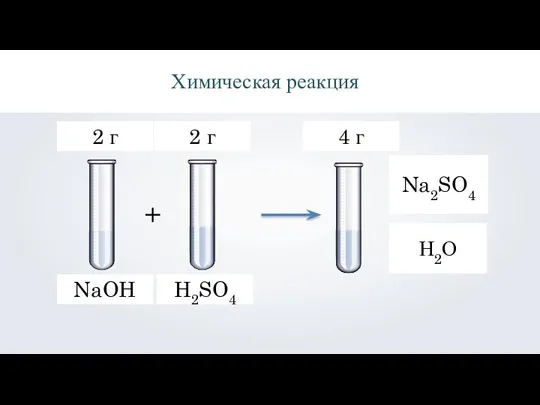
- 5. NaOH Н2О Na2SO4 H2SO4 Химическая реакция 2 г 2 г 4 г +
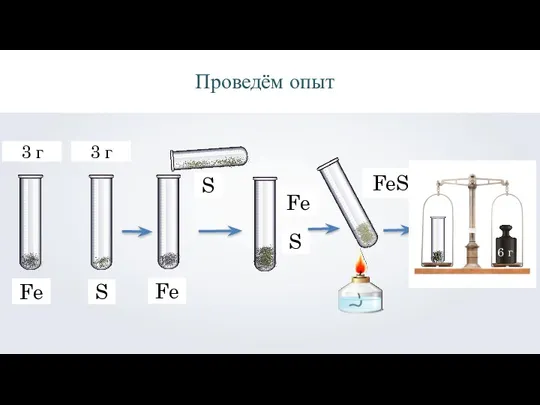
- 6. Fe S Проведём опыт FeS 3 г 3 г Fe S Fe S
- 7. Химическое уравнение — это условная запись химических реакций с помощью химических формул и математических знаков. Уравнения
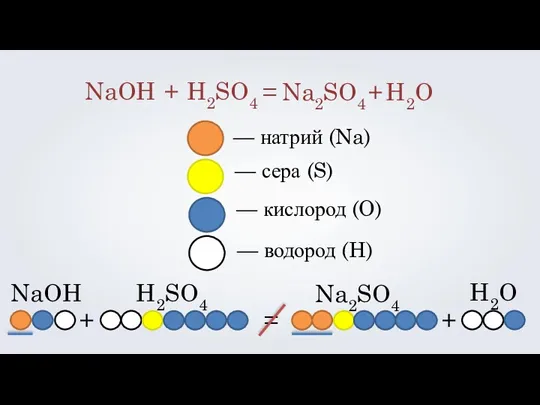
- 8. NaOH H2SO4 + = Na2SO4 + H2O — натрий (Na) — сера (S) — кислород (O)
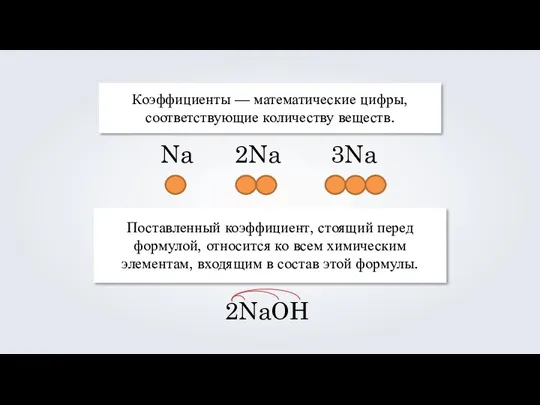
- 9. Коэффициенты — математические цифры, соответствующие количеству веществ. Поставленный коэффициент, стоящий перед формулой, относится ко всем химическим
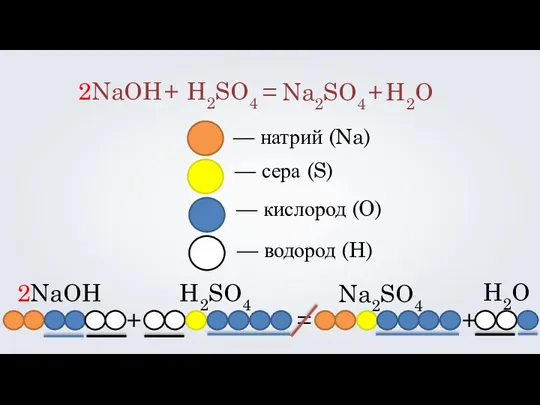
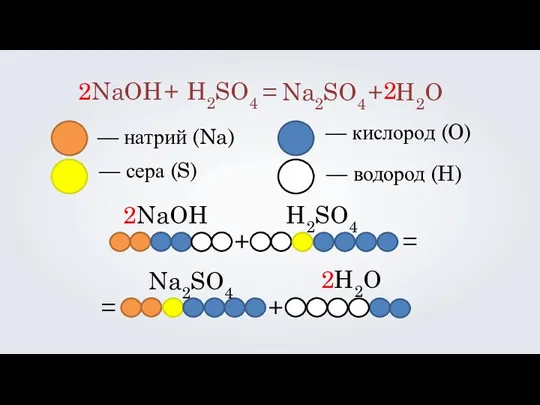
- 10. 2NaOH H2SO4 + = Na2SO4 + H2O — натрий (Na) — сера (S) — кислород (O)
- 11. 2NaOH H2SO4 + = Na2SO4 + H2O — натрий (Na) — сера (S) — кислород (O)
- 12. 2NaOH H2SO4 + = Na2SO4 + H2O 2 С помощью коэффициентов мы уравниваем левую часть записи
- 13. Правила расстановки коэффициентов N2 + O2 → NO2 N N O O Простые вещества
- 14. Правила расстановки коэффициентов N2 + O2 → NO2 · 2 1· 2 1· 2 N2 +
- 15. Правила расстановки коэффициентов Сложные вещества H3PO4 + Na2CO3 → Na3PO4 + CO2↑ + H2O H3PO4 Na2CO3
- 16. Алгоритм уравнивания Рассматриваем, входит ли в схему реакции соль. Именно с неё начинается уравнивание реакции. H3PO4
- 17. Алгоритм уравнивания Если в реакцию вступают две соли, уравнивание начинается с соли, содержащей наибольшее число ионов.
- 19. Скачать презентацию







 VIВ тобының элементтері. Хром. Хром және оның қосылыстарының қасиеттер
VIВ тобының элементтері. Хром. Хром және оның қосылыстарының қасиеттер Строение атома. Тема 2
Строение атома. Тема 2 Кислородные соединения азота
Кислородные соединения азота Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Спирты, фенолы, тиолы
Спирты, фенолы, тиолы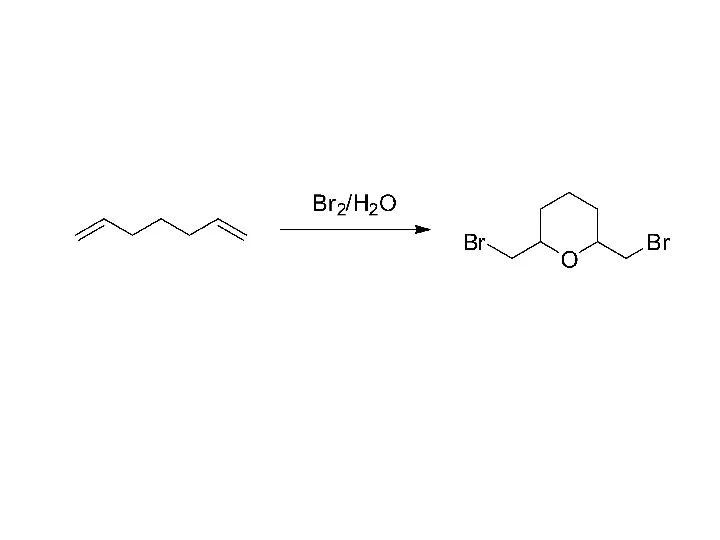 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Топливный элемент: проблемы и перспективы
Топливный элемент: проблемы и перспективы Углерод. Аллотропные состояния углерода
Углерод. Аллотропные состояния углерода Обмен липидов
Обмен липидов Классификация неорганический веществ
Классификация неорганический веществ Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли Век пластмасс
Век пластмасс Степень окисления элементов
Степень окисления элементов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества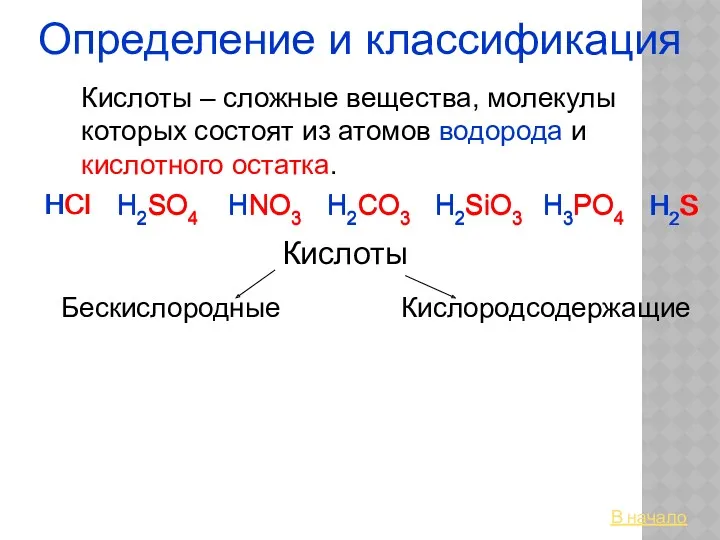 Кислоты. Определение и классификация
Кислоты. Определение и классификация Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены
Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены Соединения железа Fe+2 и Fe+3
Соединения железа Fe+2 и Fe+3 Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Хлороводород, соляная кислота. Химические свойства соляной кислоты
Хлороводород, соляная кислота. Химические свойства соляной кислоты Основания, их классификация и свойства в свете ТЭД
Основания, их классификация и свойства в свете ТЭД Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды бензол
бензол Синтетические моющие средства
Синтетические моющие средства Механизмы органических реакций. (Лекция 2)
Механизмы органических реакций. (Лекция 2) Химические формулы
Химические формулы