Содержание
- 2. Целью дисциплины является изучение теоретических основ химико-технологических процессов тонкого органического, основного и нефтехимического синтеза. - Механизмы
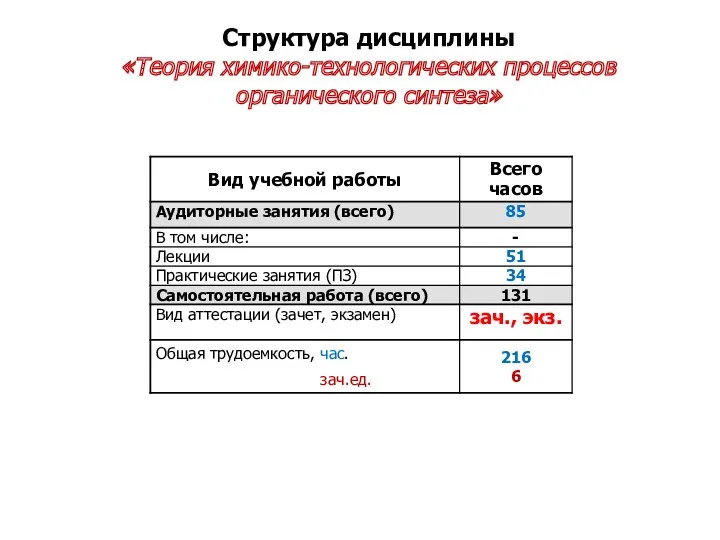
- 3. Структура дисциплины «Теория химико-технологических процессов органического синтеза»
- 4. Основная: Лебедев Н.Н., Манаков М.Н., Швец В.Ф. Теория химических процессов основного органического и нефтехимического синтеза. –
- 5. ЛИТЕРАТУРА Дополнительная: Лисицин В.Н. Химия и технология промежуточных продуктов. - М.: Химия, 1987. - 376с. Лисицын
- 6. Жоров Ю.М. Кинетика промышленных органических реакций. – М.: Химия, 1989. – 384 с. Жоров Ю.М. Термодинамика
- 7. МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ Химические реакции рассматриваются как превращение исходных органических веществ в продукты при неизменности ядер
- 8. В случае сложных реакций наиболее медленно протекающая стадия определяет скорость всего процесса. Таким образом, понятие «механизм
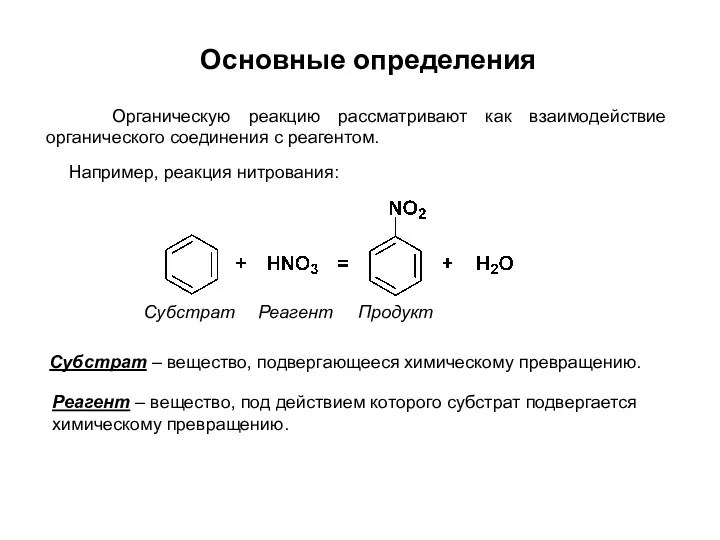
- 9. Например, реакция нитрования: Субстрат – вещество, подвергающееся химическому превращению. Реагент – вещество, под действием которого субстрат
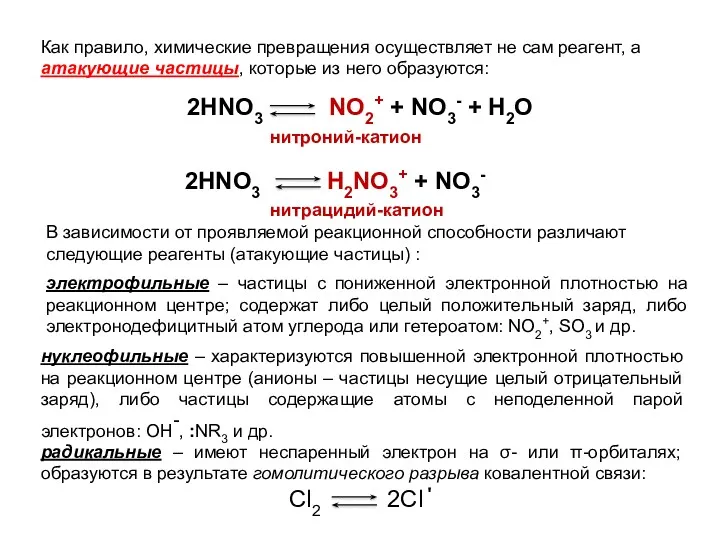
- 10. Как правило, химические превращения осуществляет не сам реагент, а атакующие частицы, которые из него образуются: 2HNO3
- 11. Классификация органических реакций 1. Гомолитические. Ковалентная связь образуется в результате обобщения двух электронов, причем каждый атом,
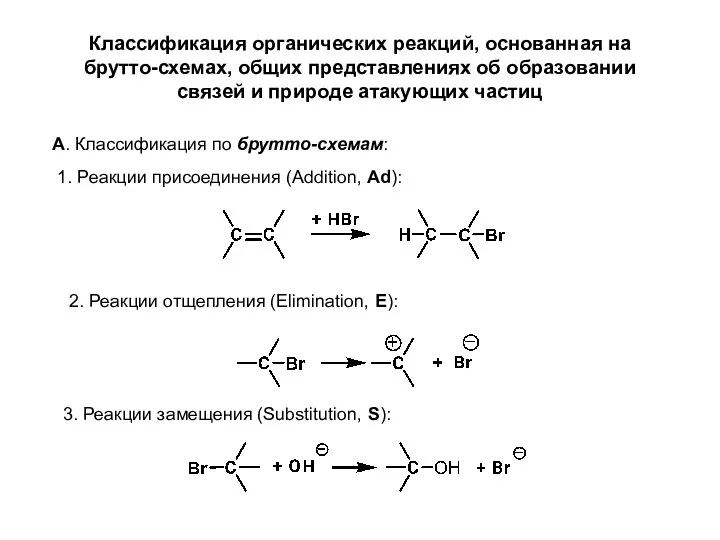
- 12. Классификация органических реакций, основанная на брутто-схемах, общих представлениях об образовании связей и природе атакующих частиц А.
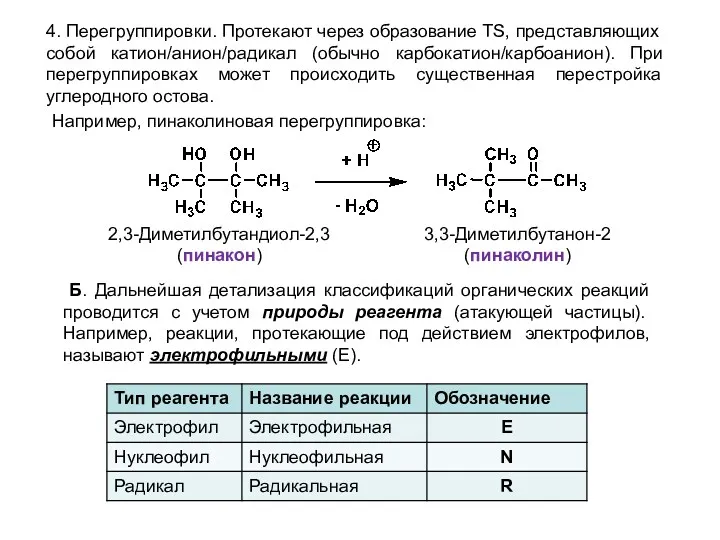
- 13. 4. Перегруппировки. Протекают через образование TS, представляющих собой катион/анион/радикал (обычно карбокатион/карбоанион). При перегруппировках может происходить существенная
- 14. В. Количество частиц, участвующих на стадии, определяющей скорость реакции в целом: - мономолекулярная реакция 1; -
- 15. Существуют также и другие классификации, например, по характеру реагентов и продуктов реакции: - сульфирование - нитрование
- 16. Взаимное влияние атомов в молекулах органических соединений Заместители (функциональные группы) – атомы или группы атомов, являющиеся
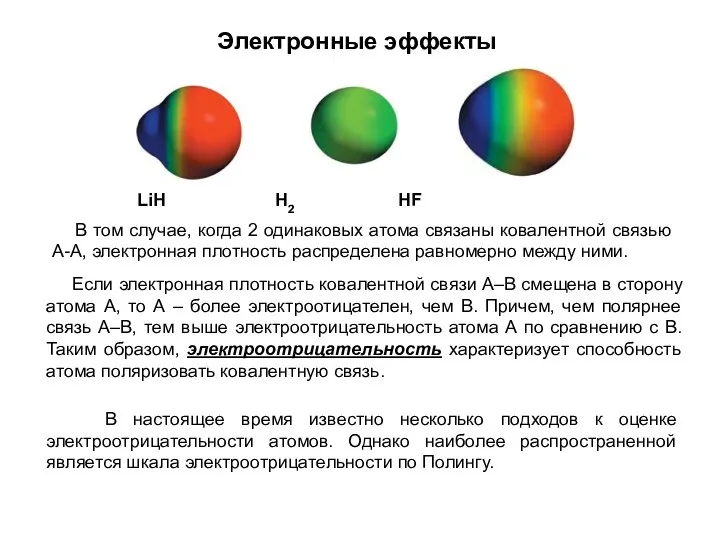
- 17. Электронные эффекты В том случае, когда 2 одинаковых атома связаны ковалентной связью А-А, электронная плотность распределена
- 18. Разность электроотрицательностьей двух атомов А и В (χA и χB) определяется по формуле: где ЕАВ, ЕАА,
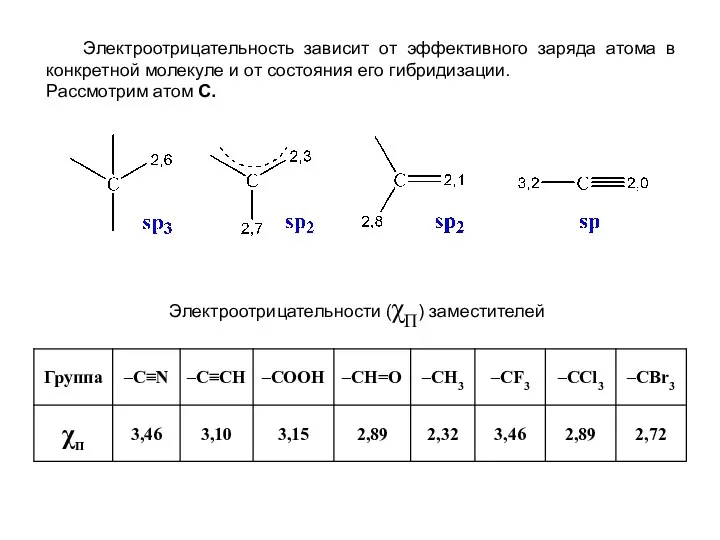
- 19. Электроотрицательность зависит от эффективного заряда атома в конкретной молекуле и от состояния его гибридизации. Рассмотрим атом
- 20. Есть и другие шкалы. Например, электроотрицательность по Малликену рассчитывается по формуле: где I – потенциал ионизации
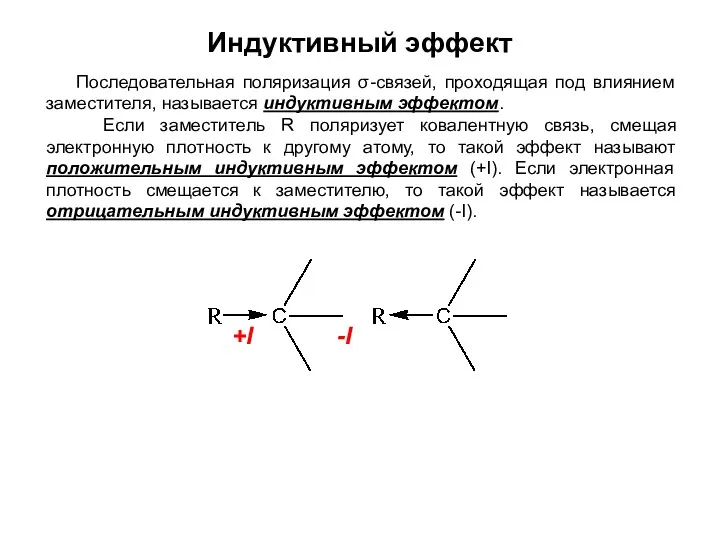
- 21. Индуктивный эффект Последовательная поляризация σ-связей, проходящая под влиянием заместителя, называется индуктивным эффектом. Если заместитель R поляризует
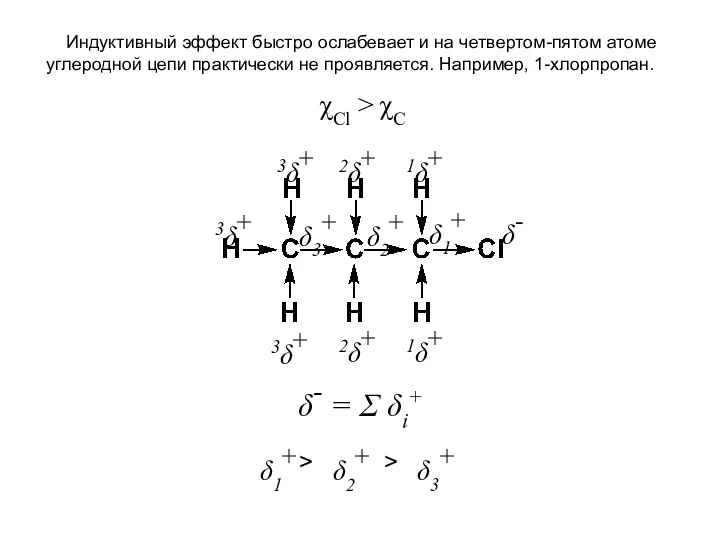
- 22. Индуктивный эффект быстро ослабевает и на четвертом-пятом атоме углеродной цепи практически не проявляется. Например, 1-хлорпропан. δ-
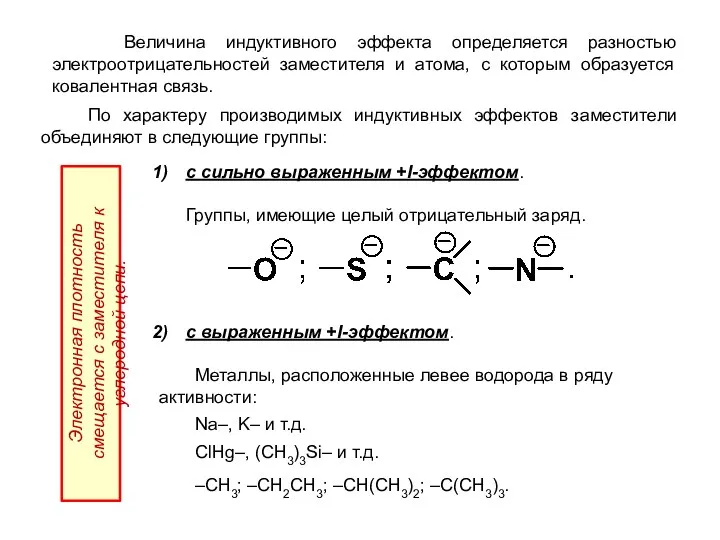
- 23. Величина индуктивного эффекта определяется разностью электроотрицательностей заместителя и атома, с которым образуется ковалентная связь. По характеру
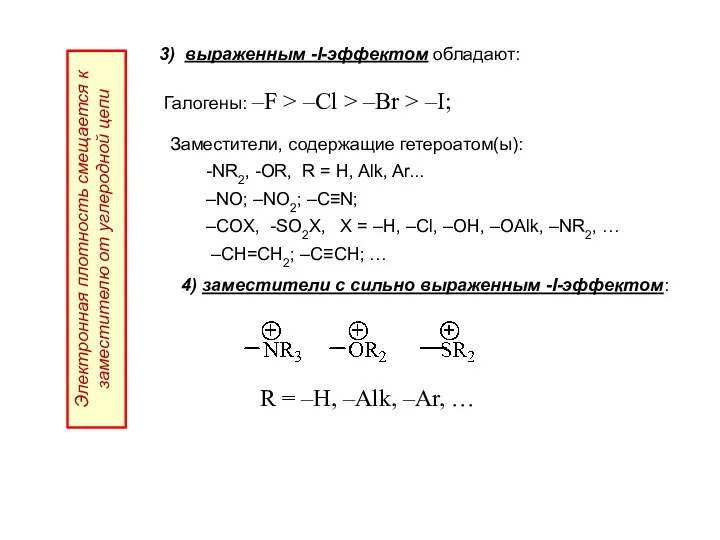
- 24. 3) выраженным -I-эффектом обладают: Галогены: –F > –Cl > –Br > –I; Электронная плотность смещается к
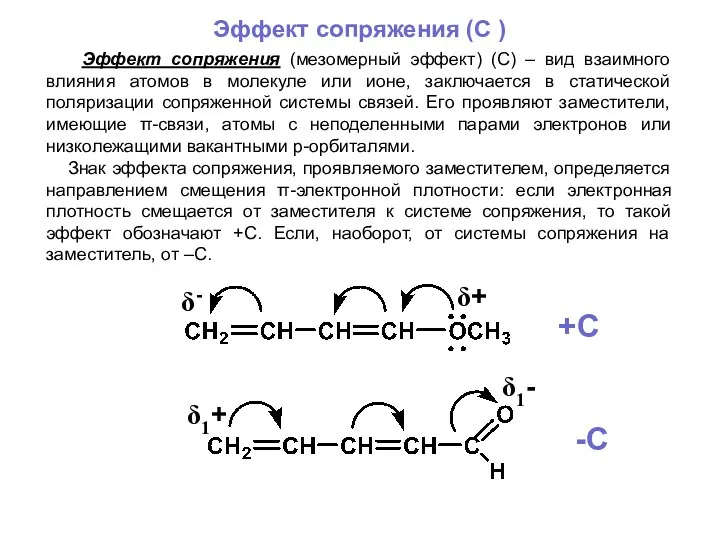
- 25. Эффект сопряжения (C ) Эффект сопряжения (мезомерный эффект) (С) – вид взаимного влияния атомов в молекуле
- 26. +С-эффект проявляют заместители, имеющие неподеленную пару электронов на атоме, непосредственно связанном с системой сопряжения: .. –NR2;
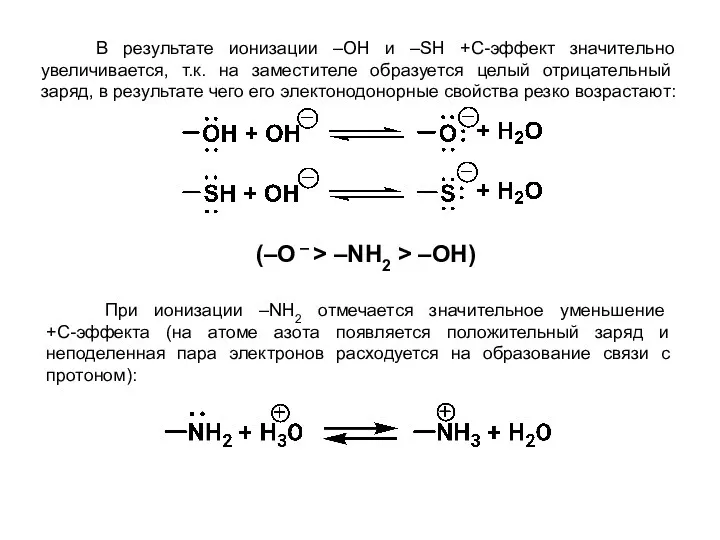
- 27. В результате ионизации –OН и –SН +С-эффект значительно увеличивается, т.к. на заместителе образуется целый отрицательный заряд,
- 29. Скачать презентацию













 Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Химия в косметологии
Химия в косметологии Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Методы получения порошков карбидов
Методы получения порошков карбидов Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Строение атома
Строение атома Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Значення хімії у житті людини
Значення хімії у житті людини Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Применение солей
Применение солей Строение вещества. Химическая связь
Строение вещества. Химическая связь Хімічна рівновага
Хімічна рівновага Почему нефть называют черным золотом
Почему нефть называют черным золотом фосфор
фосфор алкадиены
алкадиены Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Материалы с высокой удельной прочностью
Материалы с высокой удельной прочностью Кристаллические решетки
Кристаллические решетки Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Фенол и его свойства
Фенол и его свойства Су қоймасындағы тіршілік үшін темірдің рөлі
Су қоймасындағы тіршілік үшін темірдің рөлі Полисахариды. Крахмал
Полисахариды. Крахмал Азотсодержащие органические соединения. Амины (часть 1)
Азотсодержащие органические соединения. Амины (часть 1)