Содержание
- 2. Гибридизация атомных орбиталей- это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного
- 3. Если у атомов A молекулы ABn имеется неподеленная пара электронов (на s или на р-подуровне), то
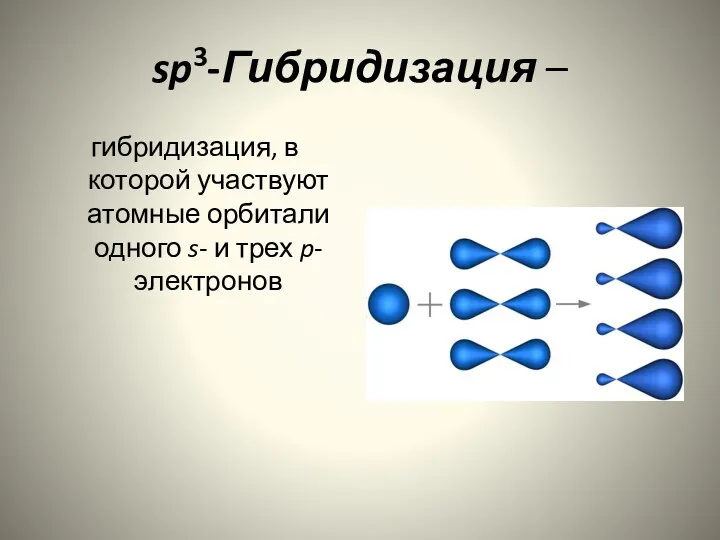
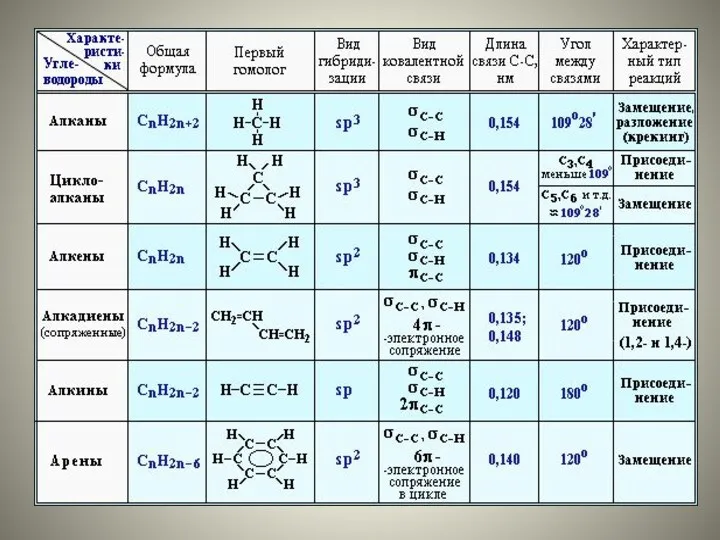
- 4. sp3-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов
- 5. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'
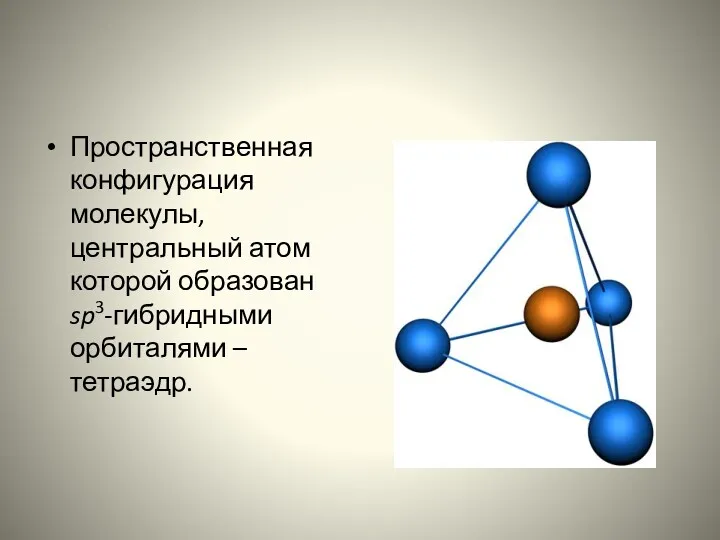
- 6. Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр.
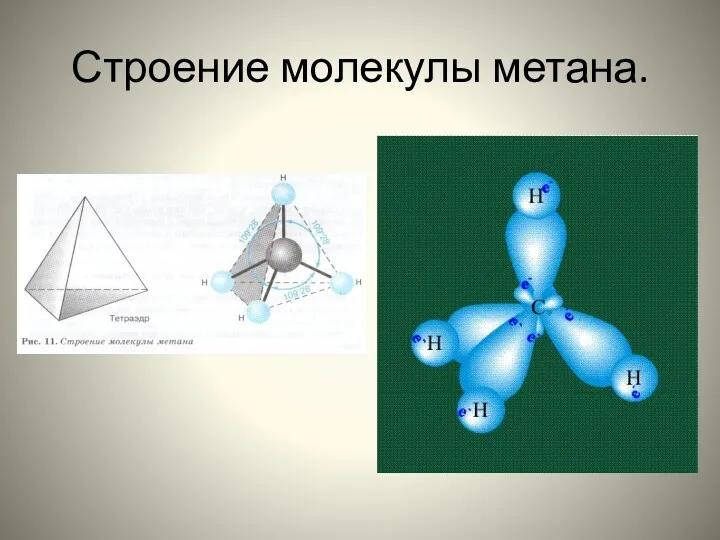
- 7. Строение молекулы метана.
- 8. Примеры соединений, для которых характерна sp3-гибридизация: H2O, NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+. Также, sp3-гибридизация наблюдается
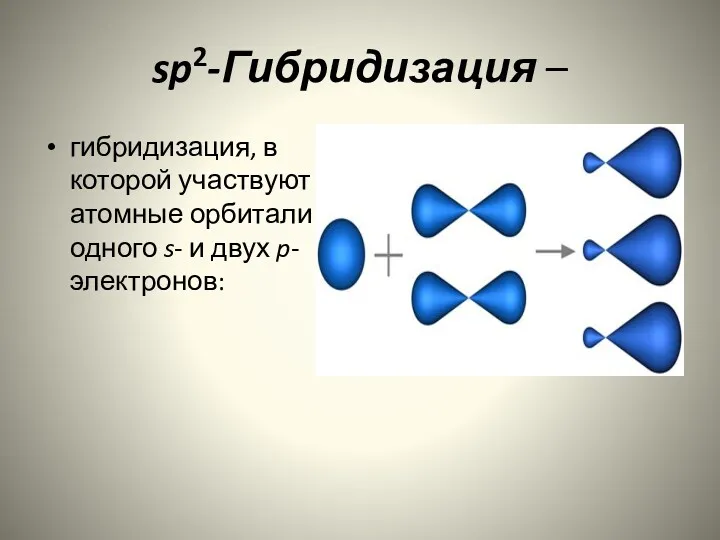
- 9. sp2-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов:
- 10. В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг
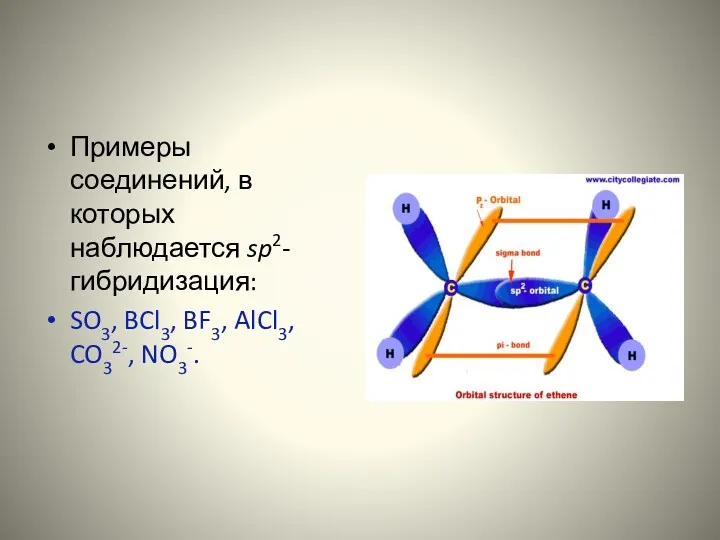
- 11. Строение молекулы этилена. Атомы углерода, находящиеся во втором валентном состоянии (sp2-гибридизация) связаны друг с другом двойными
- 12. Примеры соединений, в которых наблюдается sp2-гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-.
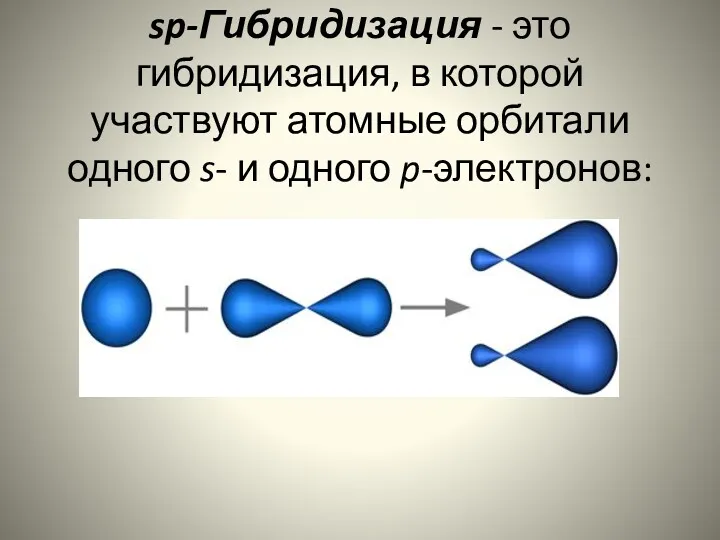
- 13. sp-Гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов:
- 14. В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°.
- 15. Примеры химических соединений, для которых характерна sp-гибридизация: BeCl2, BeH2, CO, CO2, HCN. Также sp-гибридизация наблюдается во
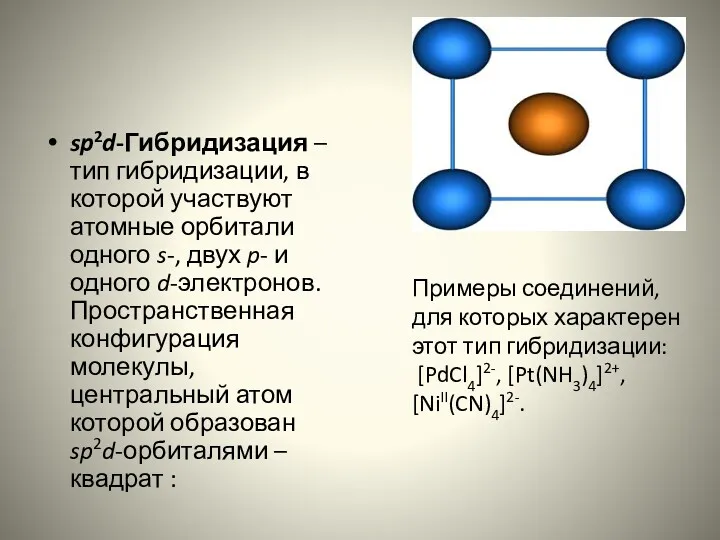
- 16. sp2d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, двух p- и одного d-электронов.
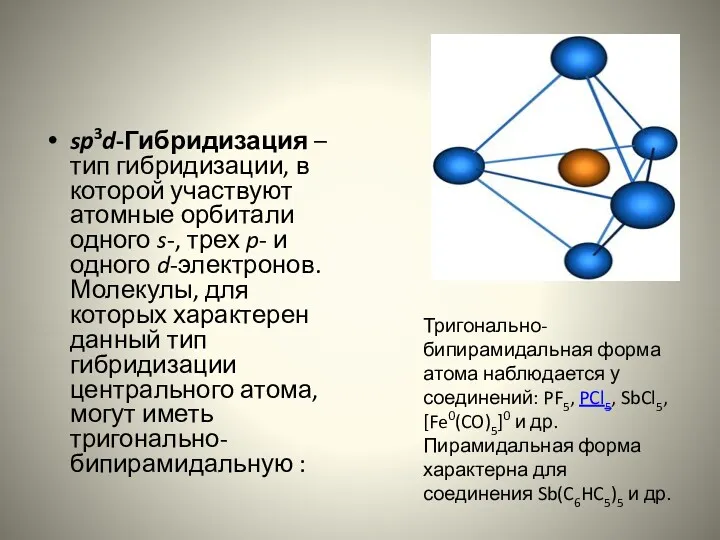
- 17. sp3d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов.
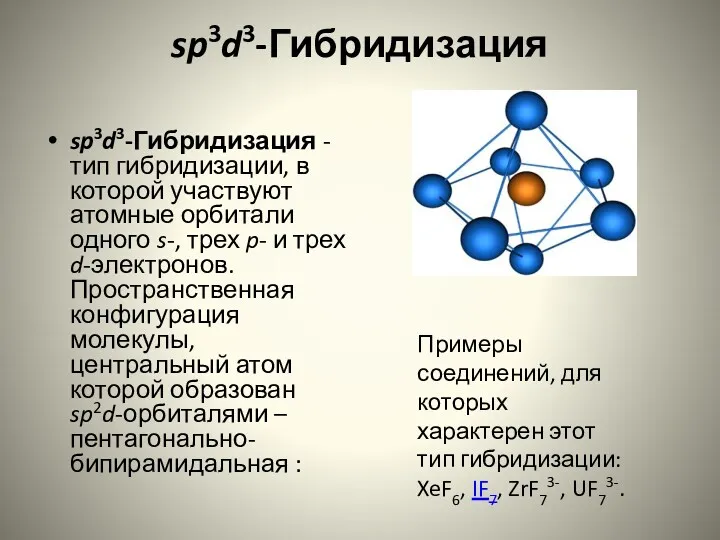
- 18. sp3d3-Гибридизация sp3d3-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех
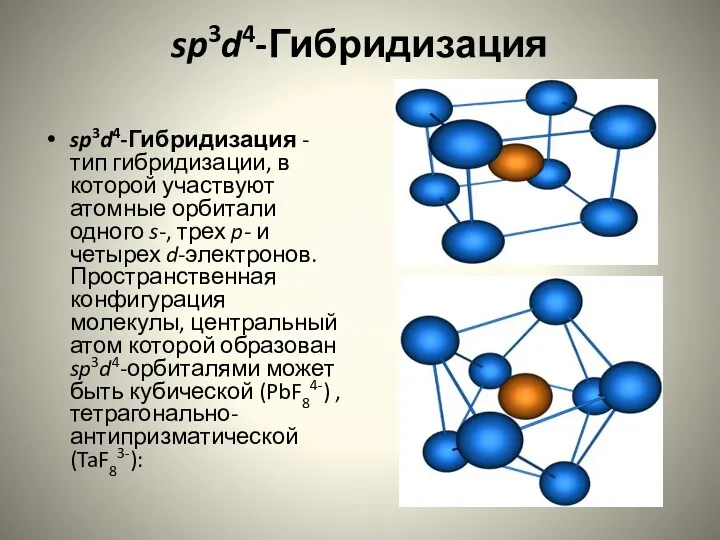
- 19. sp3d4-Гибридизация sp3d4-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех
- 21. Строение молекула BeH2 1. Оценим степени окисления элементов: Be+2H2-1 2. Запишем сокращенные электронные конфигурации атомов и
- 22. 4. Связи Be–H в молекуле BeH2 равнозначны, поэтому предполагается, что у атома бериллия одна 2s- и
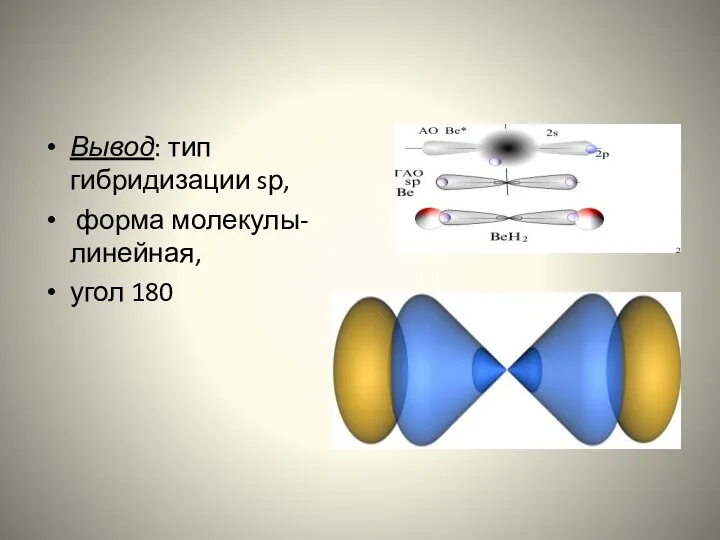
- 23. Вывод: тип гибридизации sр, форма молекулы-линейная, угол 180
- 24. Строение молекулы ВF3 1. B+3F3-1 2. B+3 (2s22p1) и F-1 (2s22p5) 3.На один атом бора приходится
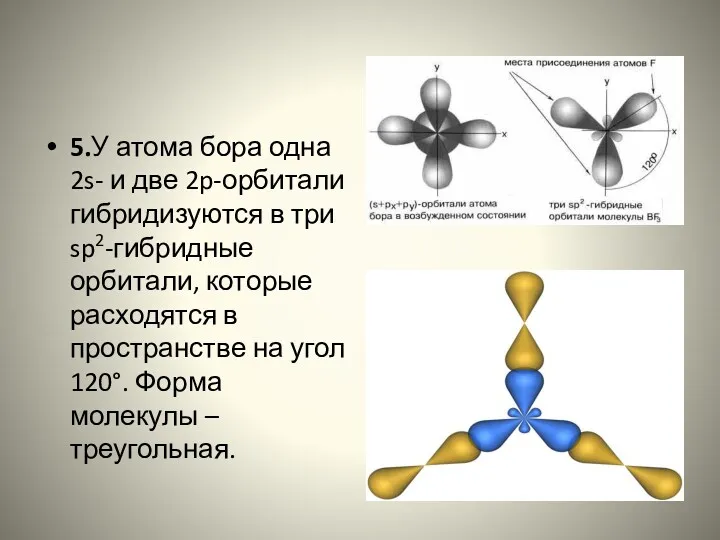
- 25. 5.У атома бора одна 2s- и две 2p-орбитали гибридизуются в три sp2-гибридные орбитали, которые расходятся в
- 26. Строение молекулы аммиака. 1. Конфигурация внешнего электронного слоя атома азота 2s22р3, водорода 1s1. 2. Валентная структура
- 27. 3.На один атом азота приходится три атома водорода, у каждого из которых по одному неспаренному электрону,
- 28. 4.В гибридизацию вступает одна s и три р-орбитали: 4 новые гибридные орбитали направлены к вершине четырехугольной
- 29. Но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в
- 30. Выберите правильный ответ . 1. Тип гибридизации электронных облаков в молекуле CF4 1) sp-; 2) sp²-;
- 31. 1. Тип гибридизации электронных облаков в молекуле СаCl2: 1) sp-; 2) sp²-; 3) sp³-; 4) spd-.
- 32. Выберите правильный ответ 1.При гибридизации происходит: 1) образование электронных орбиталей одинаковой формы и энергии; 2) выравнивание
- 33. Выберите правильный ответ 1. Тип гибридизации электронных облаков в молекуле СCl4 1) sp-; 2) sp²-; 3)
- 34. Выберите правильный ответ 1. Тип гибридизации электронных облаков в молекуле GeCl4 1) sp-; 2) sp²-; 3)
- 35. Установите соответствие Тип гибридизации: 1) sp- 2) sp2- 3) sp3- Механизм и форма молекул: а) гибридизация
- 36. Пространственная форма молекулы BF3, если угол между связями равен 120° 1) треугольная пирамида с атомом бора
- 37. Выберите правильный ответ 1. Тип гибридизации электронных облаков в молекуле BCl3 1) sp-; 2) sp²-; 3)
- 38. 1. Молекула, в которой наблюдается sp-гибридизация 1) SiH4; 2) GaBr3; 3) MgCl2; 4) CH4. 2.Молекула, имеющая
- 39. Установите соответствие Тип гибридизации Механизм образования и форма молекул. а) гибридизация одной s- и трех р-орбиталей
- 41. Скачать презентацию

























 Наноалмазы детонационного синтеза
Наноалмазы детонационного синтеза Сложные эфиры. Жиры
Сложные эфиры. Жиры Существенные изменения в измерителях ЕГЭ по химии
Существенные изменения в измерителях ЕГЭ по химии Чистые вещества и смеси
Чистые вещества и смеси Минералы и их свойства
Минералы и их свойства Химическая кинетика
Химическая кинетика Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Оксиды. Химические свойства
Оксиды. Химические свойства Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2 Основные сведения о строении атома
Основные сведения о строении атома Электронное строение атома
Электронное строение атома Геохимические барьеры
Геохимические барьеры Щелочные металлы. 9 класс
Щелочные металлы. 9 класс Алюминий и его соединения
Алюминий и его соединения Электролиз. Электролиз раствора и электролиз расплава электролита
Электролиз. Электролиз раствора и электролиз расплава электролита Значення хімії у житті людини
Значення хімії у житті людини Сталь, железо и чугун
Сталь, железо и чугун Синтетический каучук и его применение
Синтетический каучук и его применение Высокомолекулярные соединения. Общие понятия
Высокомолекулярные соединения. Общие понятия Многоатомные спирты
Многоатомные спирты III А – топтың элементтері
III А – топтың элементтері Химический анализ веществ
Химический анализ веществ Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Inert metals
Inert metals Реакции ионного обмена
Реакции ионного обмена Состояние и свойства воды
Состояние и свойства воды Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей