Содержание
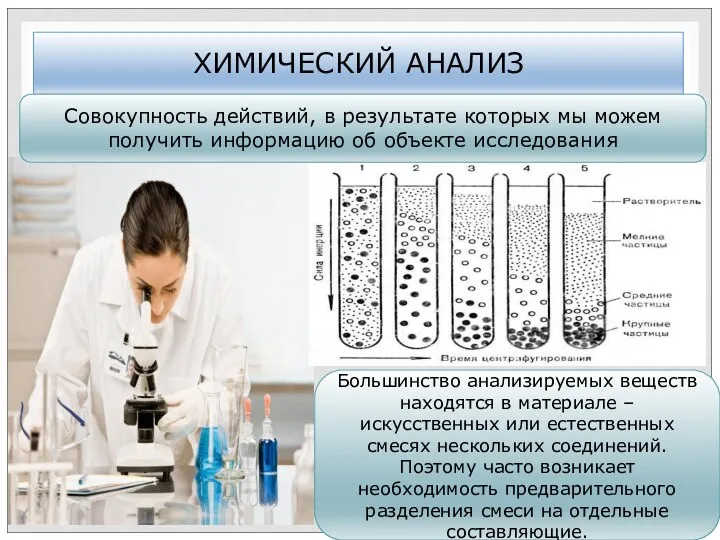
- 2. ХИМИЧЕСКИЙ АНАЛИЗ Большинство анализируемых веществ находятся в материале – искусственных или естественных смесях нескольких соединений. Поэтому
- 3. МЕТОДЫ РАЗДЕЛЕНИЯ СМЕСЕЙ Гомогенные Гетерогенные Отстаивание (различная плотность или различная смачиваемость): песок+вода, растительное масло+вода Фильтрование, экстракция
- 5. РАСТВОРЕНИЕ ТРЕТЬЕГО ВЕЩЕСТВА Если в систему, состоящую из двух несмешивающихся жидкостей ввести третье вещество, способное растворяться
- 6. ЗАКОН РАСПРЕДЕЛЕНИЯ Вещество способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его
- 7. ПРИМЕР К I2 = 130 между водой и хлороформом. Если к воде, содержащей растворенный йод, добавить
- 8. ПРИМЕР Таким образом с помощью хлороформа можно извлечь (экстрагировать) из воды преобладающую часть растворенного в ней
- 9. ЭКСТРАКЦИЯ Экстра́кция (от лат. extraho — извлекаю) — метод извлечения вещества) — метод извлечения вещества из
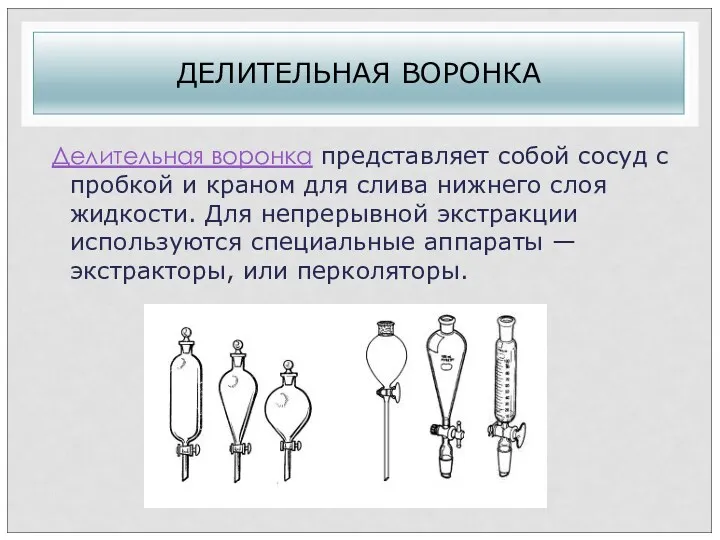
- 10. ДЕЛИТЕЛЬНАЯ ВОРОНКА Делительная воронка представляет собой сосуд с пробкой и краном для слива нижнего слоя жидкости.
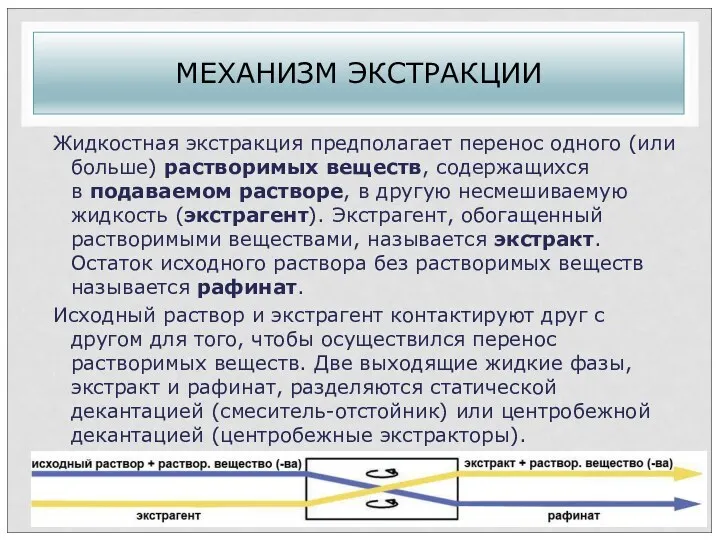
- 11. МЕХАНИЗМ ЭКСТРАКЦИИ Жидкостная экстракция предполагает перенос одного (или больше) растворимых веществ, содержащихся в подаваемом растворе, в
- 12. ТРИ СТАДИИ ЭКСТРАКЦИИ смешение исходной смеси веществ с экстрагентом; механическое разделение (расслаивание) двух образующихся фаз; удаление
- 13. МАСКИРОВАНИЕ Маскирование – это перевод мешающих компонентов в такую форму, которая уже не оказывает мешающего влияния.
- 14. ВИДЫ МАСКИРОВАНИЯ Различают два вида маскирования – термодинамическое (равновесное) и кинетическое (неравновесное): При термодинамическом маскировании создают
- 15. ПРИМЕРЫ Для маскировки широко применяются органические кислоты (лимоннаяДля маскировки широко применяются органические кислоты (лимонная, виннаяДля маскировки
- 16. ГРУППЫ МАСКИРУЮЩИХ ВЕЩЕСТВ Вещества, образующие с мешающими веществами более устойчивые соединения, чем с определяемыми. Например, образование
- 17. ЭФФЕКТИВНОСТЬ МАСКИРОВАНИЯ Для оценки эффективности маскирования пользуются индексом маскирования. Это логарифм отношения общей концентрации мешающего вещества
- 18. СООСАЖДЕНИЕ Соосаждение – это переход в осадок присутствующих в растворе посторонних веществ, которые в данных условиях
- 19. ВИДЫ СООСАЖДЕНИЯ По механизму захвата посторонних веществ различают два основных вида соосаждения: адсорбцию и окклюзию. Адсорбция
- 20. МЕТОДЫ УСТРАНЕНИЯ СООСАЖДЕНИЯ Методы устранения (или хотя бы уменьшения) соосаждения зависят от его типа. Так, окклюдированные
- 21. ПЕРЕОСАЖДЕНИЕ Еще один прием борьбы с окклюдированными примесями – переосаждение. Осадок растворяют в подходящем растворителе (растворе
- 22. МЕТОДЫ УМЕНЬШЕНИЯ АДСОРБЦИИ Для уменьшения адсорбции необходимо увеличение среднего размера частиц, повышение температуры и промывание осадка
- 23. МЕТОДЫ УМЕНЬШЕНИЯ АДСОРБЦИИ В случае аморфных осадков уменьшить содержание примесей можно так. Осаждение проводят из горячих
- 24. СТАРЕНИЕ Осадок очищается также за счет настаивания: кристаллический осадок вместе с маточным раствором оставляют на какое-то
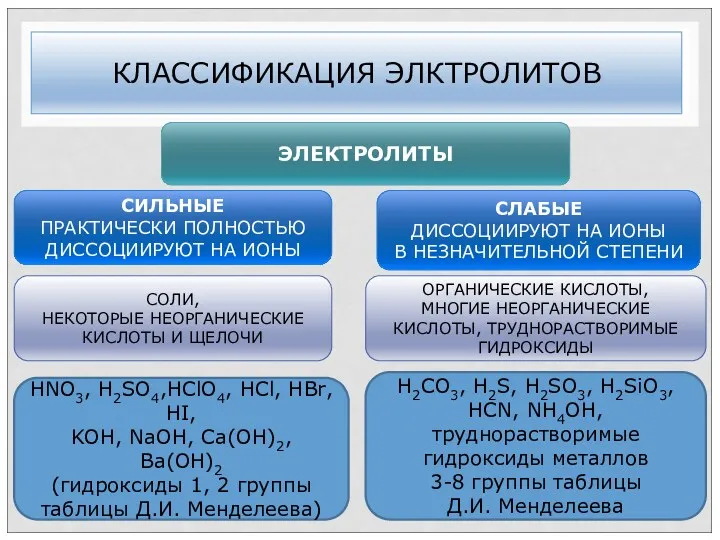
- 25. КЛАССИФИКАЦИЯ ЭЛКТРОЛИТОВ ЭЛЕКТРОЛИТЫ СИЛЬНЫЕ ПРАКТИЧЕСКИ ПОЛНОСТЬЮ ДИССОЦИИРУЮТ НА ИОНЫ СОЛИ, НЕКОТОРЫЕ НЕОРГАНИЧЕСКИЕ КИСЛОТЫ И ЩЕЛОЧИ СЛАБЫЕ
- 26. СТЕПЕНЬ ДИССОЦИАЦИИ Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие
- 27. ФАКТОРЫ ВЛИЯЮЩИЕ НА СТЕПЕНЬ ДИССОЦИАЦИИ Степень диссоциации зависит от: природы электролита природы растворителя концентрации раствора температуры
- 28. ДИССОЦИАЦИЯ МНОГООСНОВНЫХ КИСЛОТ Многоосновные кислоты диссоциируют ступенчато. Например: диссоциация угольной кислоты происходит в две ступени I.
- 29. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА Если Степень диссоциации возрастает при разбавлении раствора Закон Оствальда
- 30. ИОННАЯ СИЛА. АКТИВНОСТЬ. КОЭФФИЦИЕНТ АКТИВНОСТИ. Для оценки состояния ионов в растворах сильных электролитов вместо концентрации используют
- 31. Н2O H+ +OH- ВОДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. Вода – очень слабый амфотерный электролит. Процесс диссоциации выражается
- 32. КИСЛАЯ СРЕДА НЕЙТРАЛЬНАЯ СРЕДА ЩЕЛОЧНАЯ СРЕДА ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
- 33. РАСЧЕТ РН РАСТВОРОВ КИСЛОТ, ОСНОВАНИЙ И КИСЛОТНО-ОСНОВНЫХ БУФЕРНЫХ СИСТЕМ
- 34. СТЕПЕНЬ ГИДРОЛИЗА Степень гидролиза – число, показывающее, какая часть от общего числа молей растворенной соли подвергались
- 35. КОНСТАНТА ГИДРОЛИЗА Константа гидролиза определяет состояние химического равновесия в растворе гидролизованной соли. Если представить процесс гидролиза
- 36. При повышении температуры степень гидролиза возрастает, так как усиливается диссоциация воды и увеличивается концентрация ионов Н+
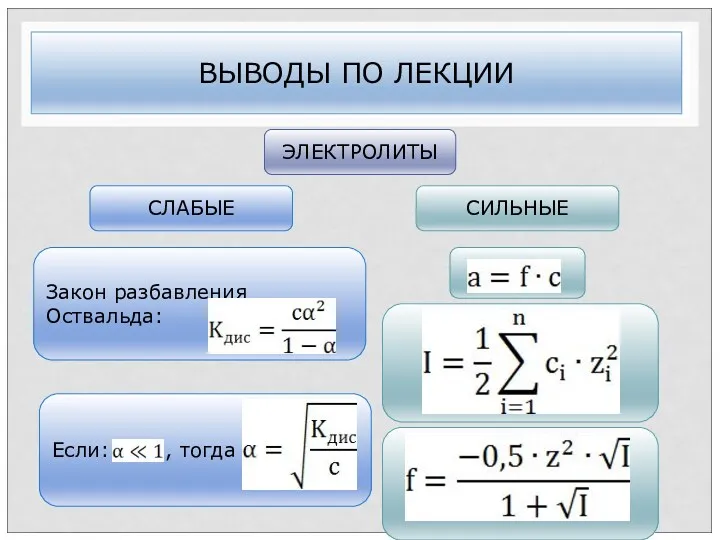
- 37. Закон разбавления Оствальда: ВЫВОДЫ ПО ЛЕКЦИИ ЭЛЕКТРОЛИТЫ СЛАБЫЕ СИЛЬНЫЕ Если: , тогда
- 38. ХРОМАТОГРАФИЯ
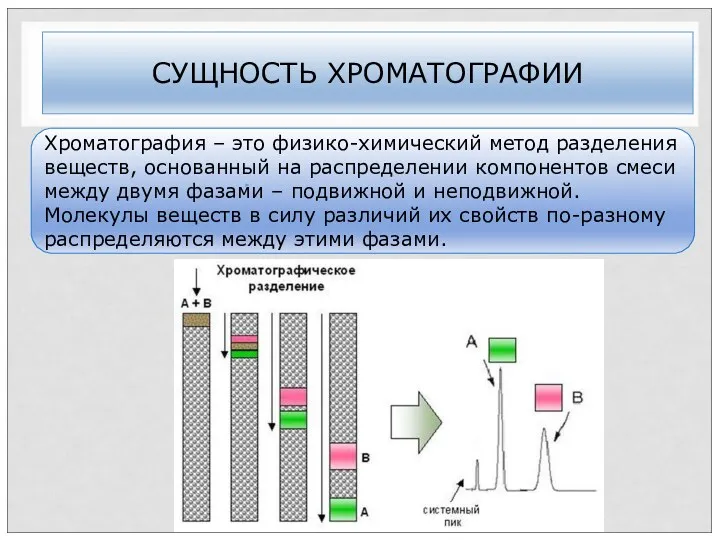
- 39. СУЩНОСТЬ ХРОМАТОГРАФИИ Хроматография – это физико-химический метод разделения веществ, основанный на распределении компонентов смеси между двумя
- 40. СУЩНОСТЬ ХРОМАТОГРАФИИ Неподвижной фазой обычно служит твердое вещество (его часто называют сорбентом или адсорбентом) или пленка
- 42. Скачать презентацию

































 Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Липиды. Классификация липидов
Липиды. Классификация липидов Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Аурум
Аурум Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Сравнение нормативов некоторых веществ
Сравнение нормативов некоторых веществ Строение атома
Строение атома Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Кислоты, их состав и названия
Кислоты, их состав и названия Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Химическая связь и ее типы. Кристаллические решетки
Химическая связь и ее типы. Кристаллические решетки Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах
Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Фенол и его свойства
Фенол и его свойства Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Физические и химические явления. Признаки химических реакций
Физические и химические явления. Признаки химических реакций Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие
Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Хроматографические методы в аналитической химии
Хроматографические методы в аналитической химии Мінеральні добрива
Мінеральні добрива Электролиз. 11 класс
Электролиз. 11 класс Щелочные металлы
Щелочные металлы Периодическая система элементов, предсказание химических свойств элементов на основе таблицы
Периодическая система элементов, предсказание химических свойств элементов на основе таблицы Углекислый газ
Углекислый газ