Содержание
- 2. Золото — элемент 11 группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным
- 3. Происхождение названия Праславянское «*zolto» («золото») родственно лит. geltonas «жёлтый», латыш. zelts «золото»; нем. gold, англ. Gold.
- 4. Физические свойства Чистое золото — мягкий металл жёлтого цвета. В тонких плёнках золото просвечивает зелёным. Золото
- 5. Цвет Блеск Твердость по шкале Мооса Температура плавления, град.С Температура кипения Плотность при температуре 20ºC ЖЕЛТЫЙ
- 6. Химические свойства Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, благодаря
- 7. 3.Единственные кислоты, которые взаимодействуют с золотом – это селеновая, хлороводородная и с царской водкой: – селеновая
- 8. Предполагается, что золото и другие элементы тяжелее железа образовались в результате разрушения нейтронных звёзд. По этой
- 9. Нахождение в природе Содержание в земной коре 4,3·10-7% по массе, в воде морей и океанов менее
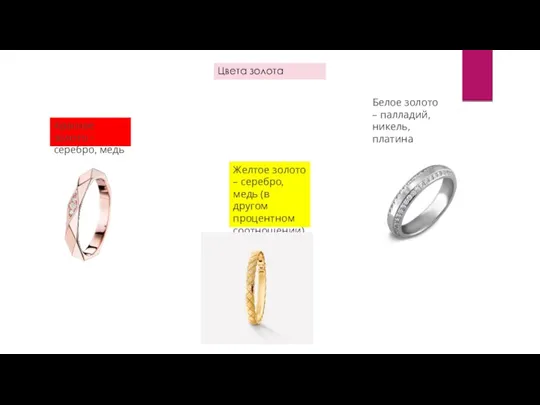
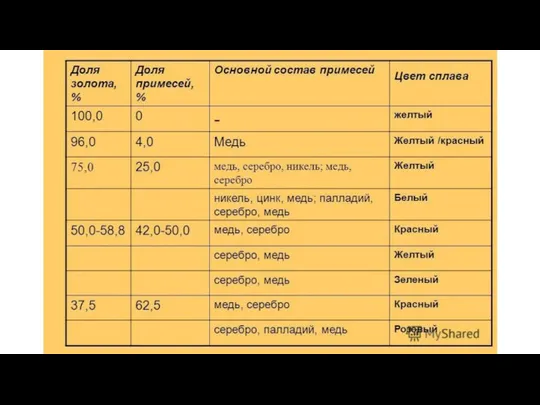
- 10. Цвета золота Красное золото – серебро, медь Желтое золото – серебро, медь (в другом процентном соотношении)
- 12. Применение золота Имеющееся в настоящее время в мире золото распределено так: около 10 % — в
- 13. Золото используется в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в
- 15. Скачать презентацию










 Основные электрохимические процессы
Основные электрохимические процессы Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Ядерное топливо
Ядерное топливо Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Основные положения ТЭД
Основные положения ТЭД Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13) Молекулы и атомы
Молекулы и атомы Генетическая связь неорганических соединений (8 класс)
Генетическая связь неорганических соединений (8 класс) Аллотропия
Аллотропия Агрегатные состояния вещества
Агрегатные состояния вещества Періодична система
Періодична система The role of chemistry in the solution of the food problem
The role of chemistry in the solution of the food problem Аминокислоты. Изомерия. Белки
Аминокислоты. Изомерия. Белки Алкадиены
Алкадиены Средства гигиены
Средства гигиены Степень окисления элементов
Степень окисления элементов АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.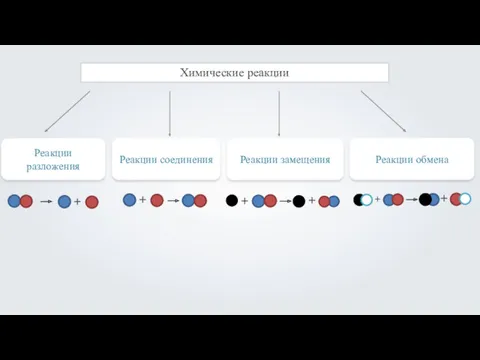 Химические реакции. Реакции разложения
Химические реакции. Реакции разложения Анионактивті беттік активті заттар
Анионактивті беттік активті заттар Серебро
Серебро Медь
Медь Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Общая характеристика неметаллов
Общая характеристика неметаллов Пневмовакуум-формование
Пневмовакуум-формование Изотопы, их свойства и применение
Изотопы, их свойства и применение Простые вещества - неметаллы
Простые вещества - неметаллы Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл