Содержание
- 2. Окислительно-восстановительные реакции (ОВР) ОВР – реакции, протекающие с изменением степеней окисления элементов, образующих молекулы и ионы
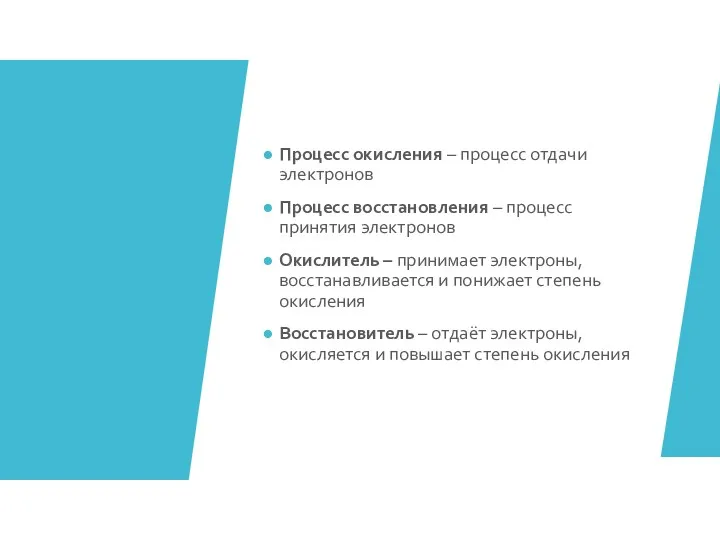
- 3. Процесс окисления – процесс отдачи электронов Процесс восстановления – процесс принятия электронов Окислитель – принимает электроны,
- 4. Вещества, содержащие атомы элементов в максимальной и минимальной степени окисления могут быть только окислителями или восстановителями.
- 5. Типы ОВР 1. Межмолекулярные – реакции, в которых атомы окислителя и восстановителя, входят в состав молекул
- 6. 2. Внутримолекулярные – реакции, в которых атомы окислителя и восстановителя, входят в состав молекулы одного и
- 7. 3.Самоокисления-самовосстановления (диспропорционирования) – реакции, в которых атомы окислителя и восстановителя входят в состав одного и того
- 8. 4. Контрпропорционирования – реакции, в которых атомы окислителя и восстановителя входят в состав различных исходных веществ,
- 9. Роль окислительно-восстановительных реакций Окислительно-восстановительные реакции широко используются в добыче нефти и газа. Например, окислители используются для
- 10. Многие процессы нефтехимического синтеза основаны на окислительно-восстановительных реакциях (получение органических кислот, спиртов, альдегидов). СН4 + О2
- 11. Окислительно-восстановительные процессы происходят при сгорании топлива и коррозии металлов. При коррозии чаще всего это - окисление
- 12. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ Электрохимические процессы - это окислительно-восстановительные реакции, которые сопровождаются возникновением электрического тока или вызываются электрическим
- 13. Группы электрохимических процессов процессы превращения электрической энергии в химическую (электролиз); процессы превращения химической энергии в электрическую
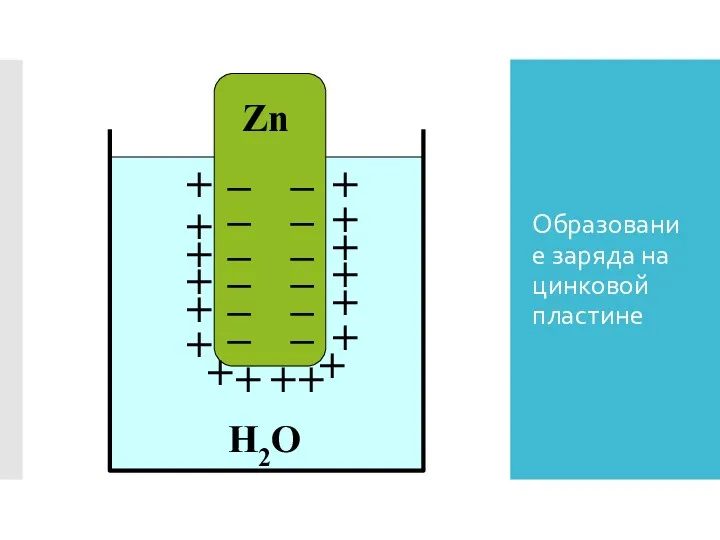
- 14. Электродный потенциал При погружении в раствор электролита или воды активного металла его поверхностные ионы, находящиеся в
- 15. Образование заряда на цинковой пластине
- 16. Электродный потенциал Абсолютные значения электродных потенциалов экспериментально определить невозможно. Потенциал каждого электрода зависит от природы металла,
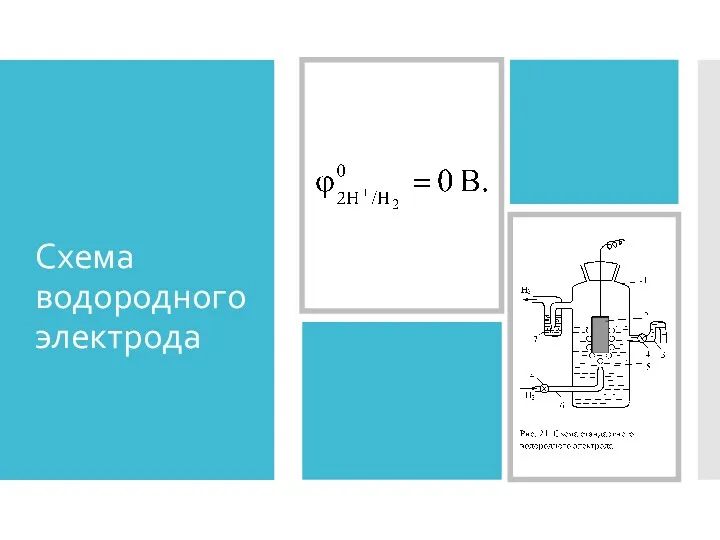
- 17. Стандартный электродный потенциал металла потенциал металла, измеренный относительно водородного электрода при стандартных условиях ( Р=101,3кПа, Т=298К,
- 18. Стандартный электродный потенциал Абсолютное значение электродного потенциала определить невозможно. Поэтому измеряют относительную величину потенциала в стандартных
- 19. Схема водородного электрода
- 20. Электроды сравнения Металл, на который нанесён слой плохо растворимой соли, погружён в раствор хорошо растворимой соли,
- 21. Ряд напряжений металлов
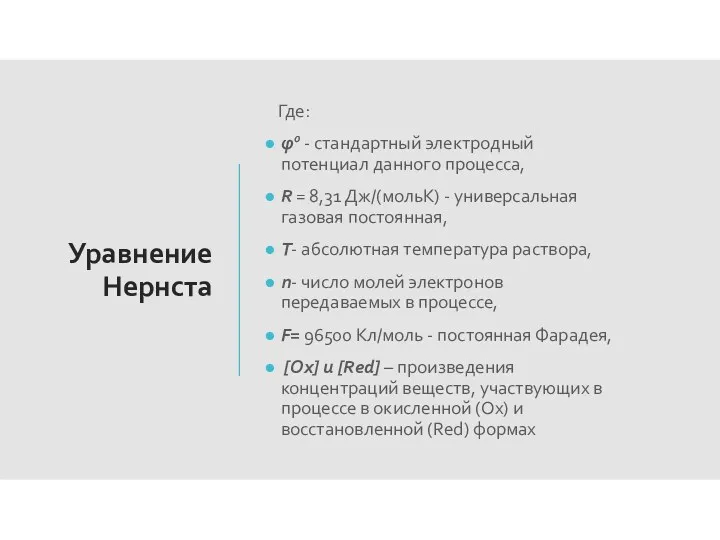
- 22. Уравнение Нернста Электродные потенциалы зависят от природы веществ, участвующих в электродном процессе, от соотношения между активностями
- 23. Уравнение Нернста Где: φ0 - стандартный электродный потенциал данного процесса, R = 8,31 Дж/(мольК) - универсальная
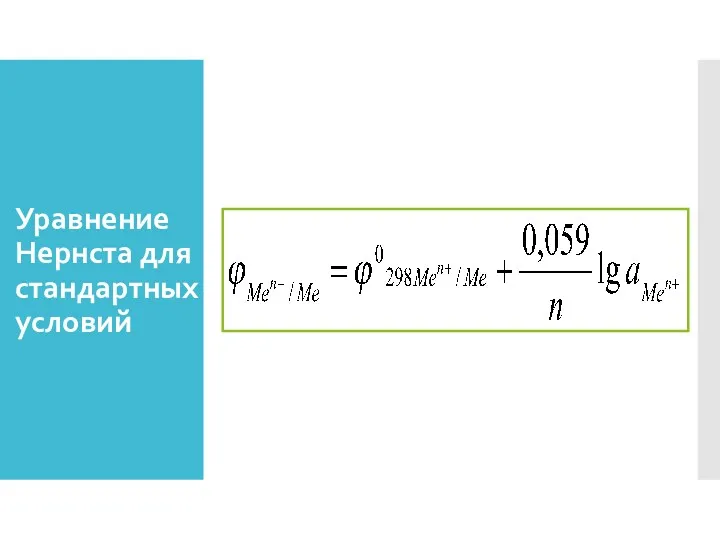
- 24. Уравнение Нернста для стандартных условий
- 25. Гальванические элементы Гальванические элементы или химические источники электрической энергии это устройства, в которых химическая энергия окислительно-восстановительной
- 26. Гальванический элемент Простейший гальванический элемент – элемент Даниэля-Якоби Анод – электрод на котором происходит окисление (более
- 27. Движение электронов во внешней цепи. Более активный металл отдает электроны менее активному Движение ионов в растворе:
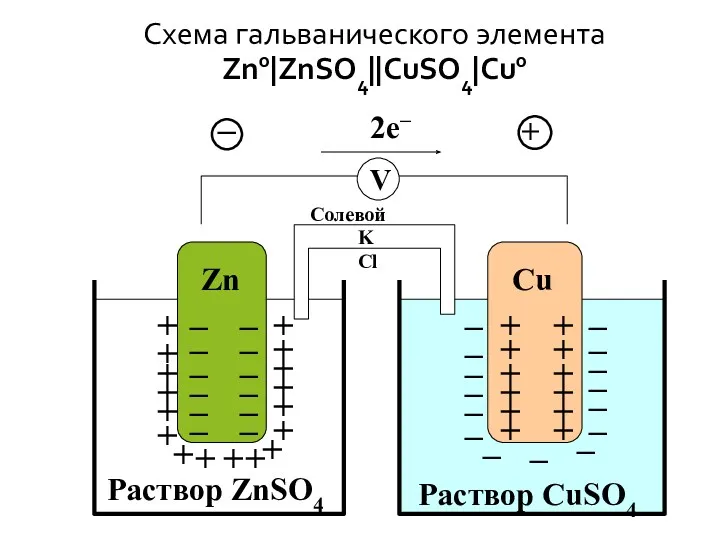
- 28. Схема гальванического элемента Zn0|ZnSO4||CuSO4|Cu0 +
- 29. Процессы на аноде и катоде Zn0|ZnSO4||CuSO4|Cu0 А: Zn0 – 2e− → Zn2+ ϕ0= − 0,76 K:
- 30. ЭДС Эффективность работы гальванического элемента оценивается величиной электродвижущей силы гальванического элемента. Электродвижущая сила – максимальное напряжение,
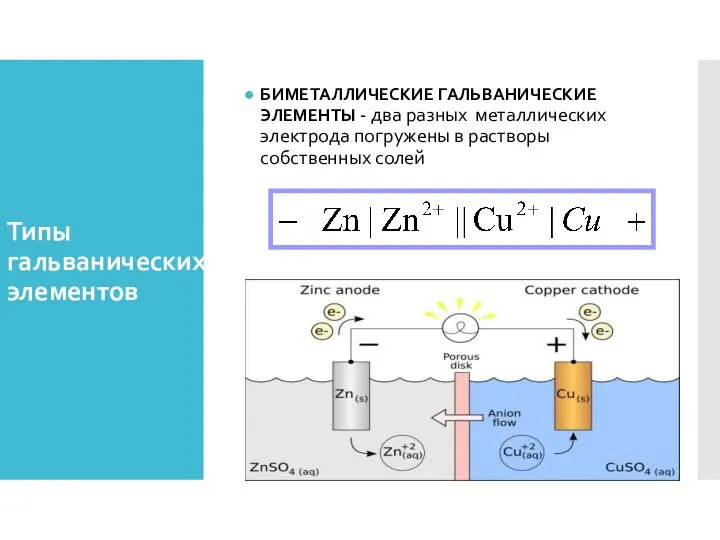
- 31. Типы гальванических элементов БИМЕТАЛЛИЧЕСКИЕ ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ - два разных металлических электрода погружены в растворы собственных солей
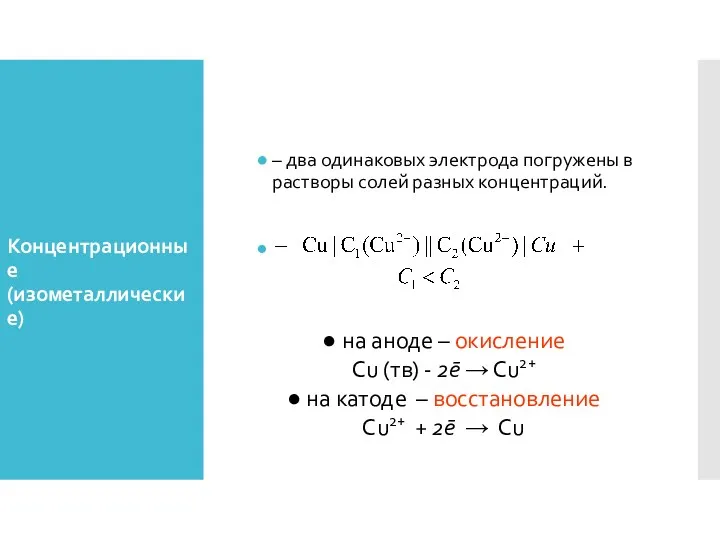
- 32. Концентрационные (изометаллические) – два одинаковых электрода погружены в растворы солей разных концентраций. ● на аноде –
- 33. Химические источники тока Электрохимический способ преобразования химической энергии в электрическую с помощью химических источников обладает рядом
- 34. Электролиз Электролиз - это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор
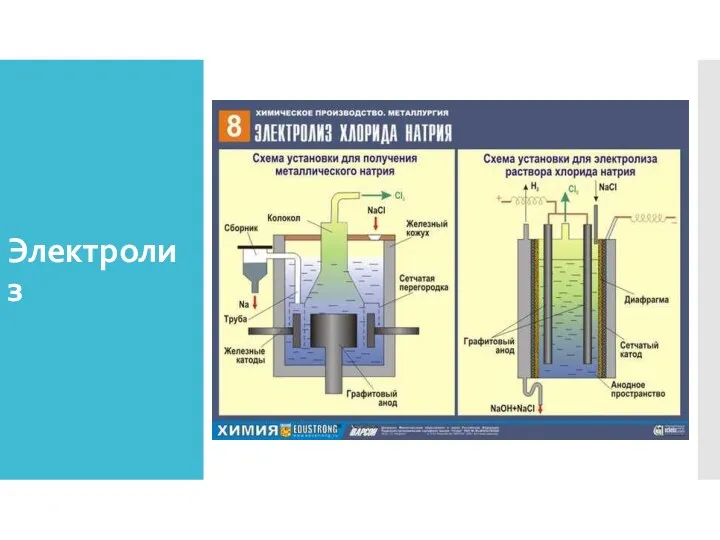
- 35. Электролиз
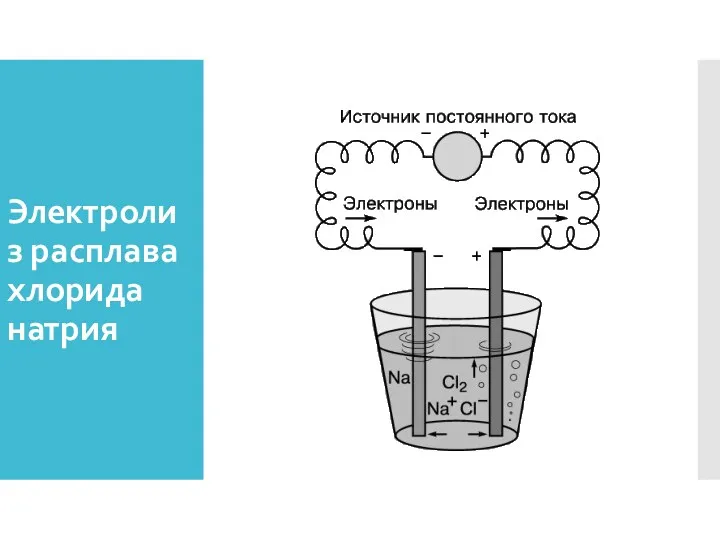
- 36. Электролиз расплава хлорида натрия
- 37. Электролиз. Правила составления уравнений электролиза Электролиз – окислительно-восстановительные реакции, протекающие на электродах при прохождении постоянного электрического
- 38. Расплавы электролитов: Катод (−): Men+ + nē = Me0 Анод (+): Анионы бескислородных кислот: 2Cl− −
- 40. Скачать презентацию



























 Оксид водорода (H2O)
Оксид водорода (H2O) Аллотропные модификации кремния
Аллотропные модификации кремния Способи очищення води в побуті
Способи очищення води в побуті Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Синтетические каучуки: хлоропреновый каучук
Синтетические каучуки: хлоропреновый каучук Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Химическая кинетика
Химическая кинетика Металлы и неметаллы
Металлы и неметаллы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Органикалық қосылыстар
Органикалық қосылыстар Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Знакомство с лабораторным оборудованием
Знакомство с лабораторным оборудованием Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химические свойства серной кислоты
Химические свойства серной кислоты Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Реакции ионного обмена
Реакции ионного обмена Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Классификация химических реакций. Признаки химических реакций
Классификация химических реакций. Признаки химических реакций Классы неорганических соединений
Классы неорганических соединений Химическая промышленность России
Химическая промышленность России Галогенопроизводные углеводородов
Галогенопроизводные углеводородов ПВХ
ПВХ Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Соединения алюминия
Соединения алюминия Альтернативная бытовая химия
Альтернативная бытовая химия Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены