Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся по составу, строению и свойствам.
- 3. Изменение цвета Изменение запаха Выделение газа Образование или растворение осадка Выделение или поглощение энергии Признаки химических
- 4. СН4 = С + Н2 NO + O2 = NO2 + Q 2KClO3 = 2KCl +
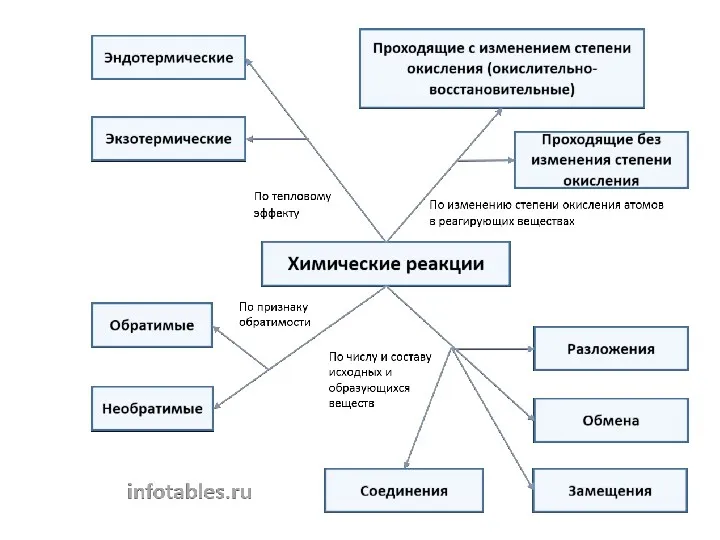
- 5. Классификация химических реакций по числу и составу исходных и полученных веществ Реакции соединения – это реакции,
- 6. Реакции разложения – это реакции, при которых из одного сложного вещества образуется несколько новых веществ. AgBr
- 7. Реакции замещения – это реакции, при которых атомы простого вещества замещают атомы одного из элементов в
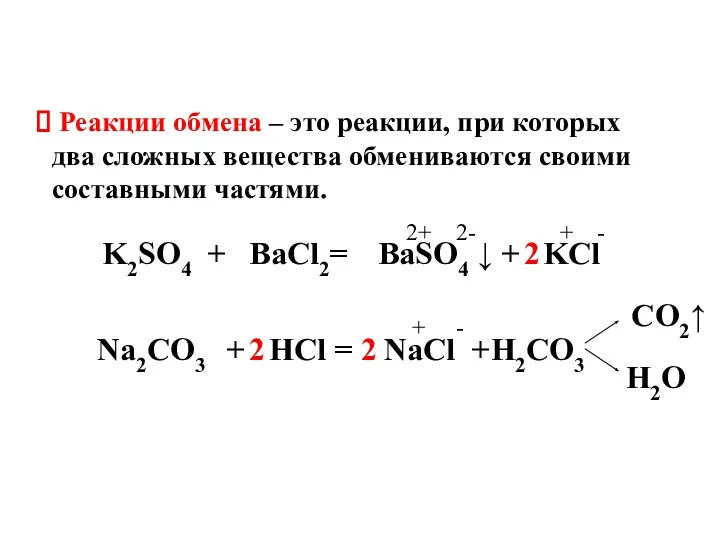
- 8. Реакции обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями. K2SO4 +
- 9. Классификация химических реакций по изменению степеней окисления элементов Окислительно – восстановительные реакции – это реакции, идущие
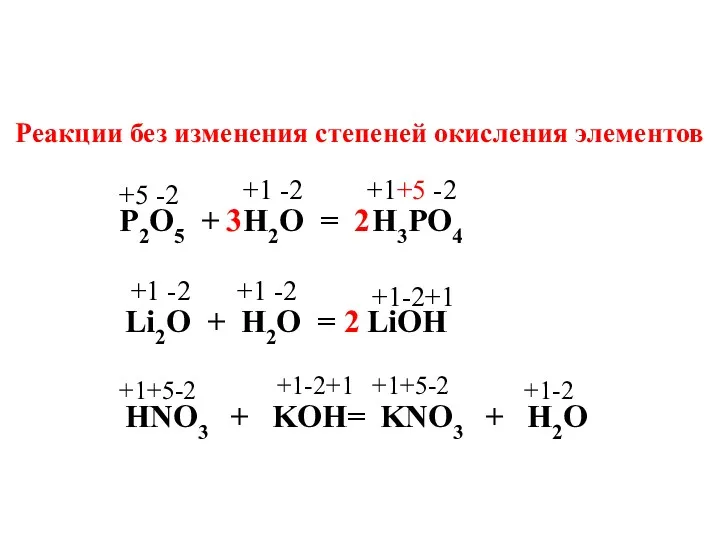
- 10. Реакции без изменения степеней окисления элементов Li2O + H2O = P2O5 + H2O = H3PO4 +5
- 11. Классификация химических реакций по поглощению или выделению энергии Экзотермические реакции- это реакции , протекающие с выделением
- 12. Классификация химических реакций по наличию или отсутствию катализатора Реакции каталитические H2O2 O2↑ + H2O MnO2 2
- 14. p, t, Fe N2 (г) + 3H2 (г) 2 NH3 (г) + Q Реакция: по числу
- 17. Скачать презентацию










 Крахма́л (C6H10O5)n
Крахма́л (C6H10O5)n Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения Химические волокна
Химические волокна Классификация химических реакций
Классификация химических реакций Щелочные металлы
Щелочные металлы Промышленное производство аммиака
Промышленное производство аммиака Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1) Создание косметических средств
Создание косметических средств Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Калийные Удобрения
Калийные Удобрения Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Количество вещества. Моль
Количество вещества. Моль Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Галогены. Общая характеристика галогенов
Галогены. Общая характеристика галогенов Аммиак
Аммиак Технология переработки полимеров
Технология переработки полимеров Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Алюминий и его соединения
Алюминий и его соединения Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены