Содержание
- 2. План лекции Аминокислоты. Определение, строение, виды классификаций. Свойства аминокислот: амфотерность, образование цвиттер-иона, образование комплекса с медью,
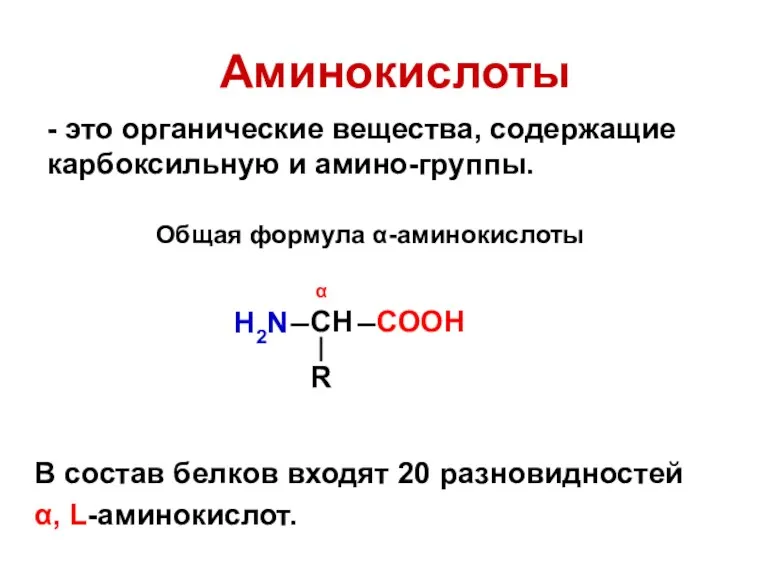
- 3. Аминокислоты - это органические вещества, содержащие карбоксильную и амино-группы. В состав белков входят 20 разновидностей α,
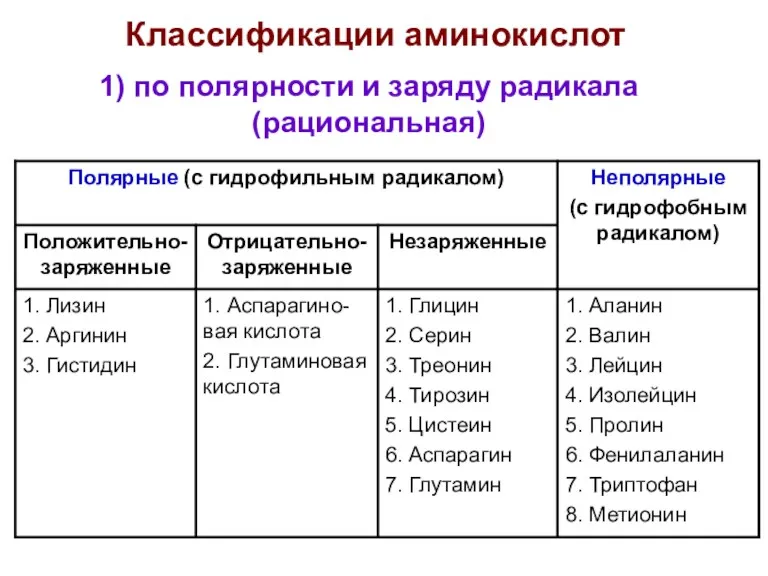
- 4. 1) по полярности и заряду радикала (рациональная) Классификации аминокислот
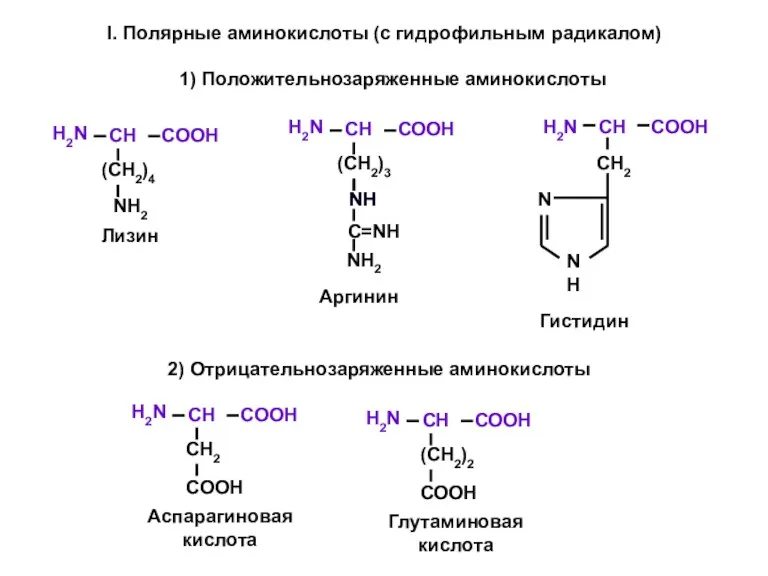
- 5. 2) Отрицательнозаряженные аминокислоты 1) Положительнозаряженные аминокислоты I. Полярные аминокислоты (с гидрофильным радикалом)
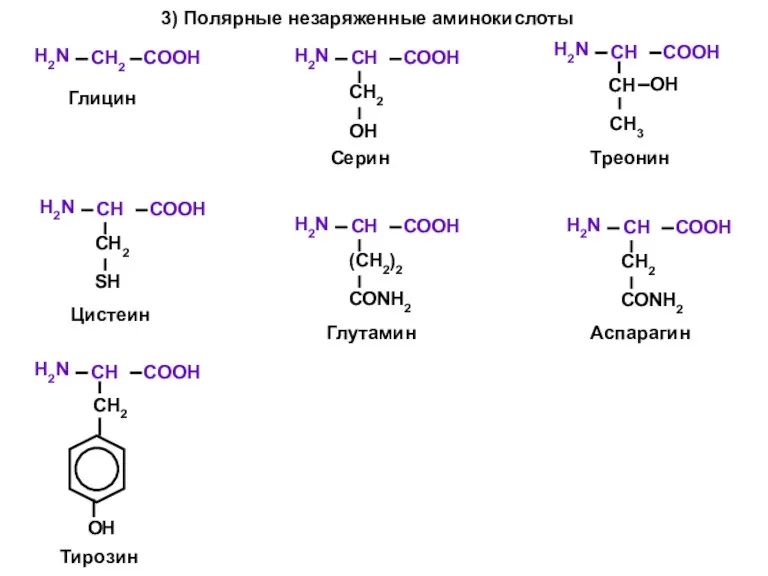
- 6. 3) Полярные незаряженные аминокислоты
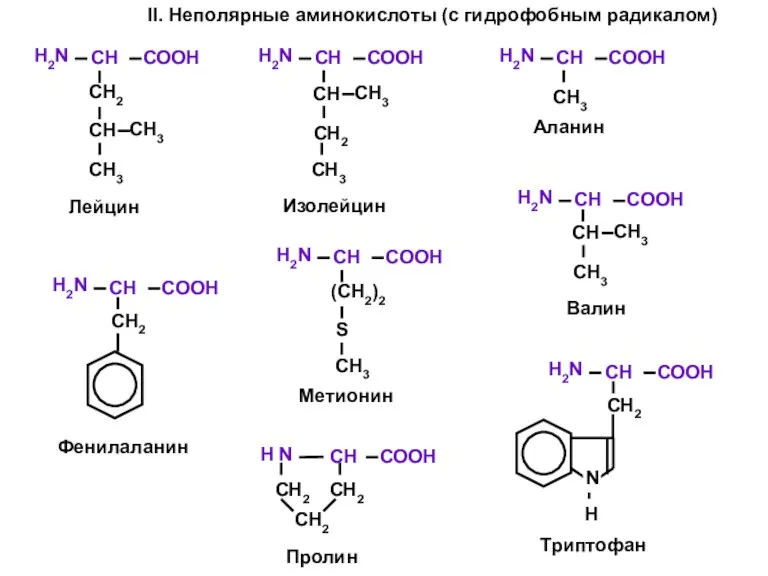
- 7. II. Неполярные аминокислоты (с гидрофобным радикалом)
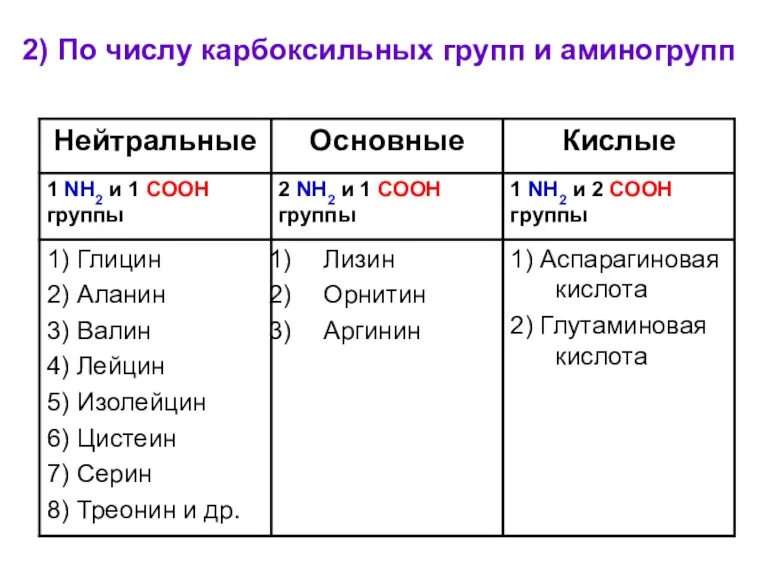
- 8. 2) По числу карбоксильных групп и аминогрупп
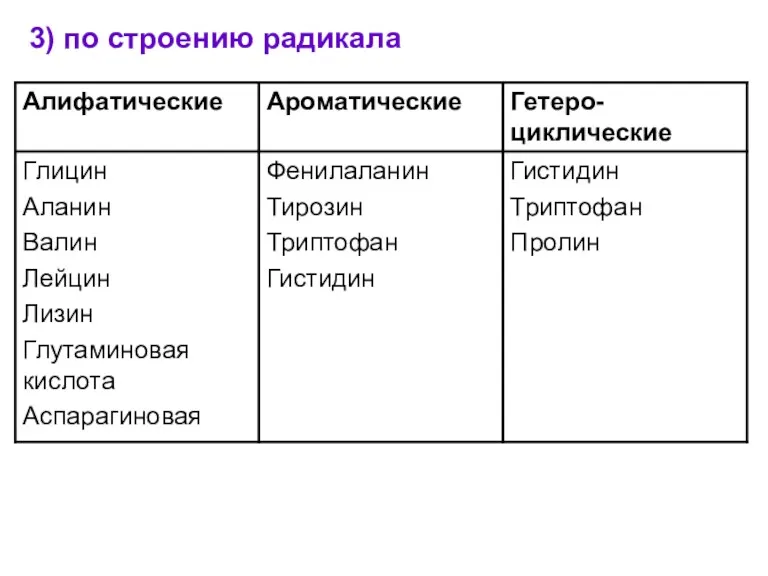
- 9. 3) по строению радикала
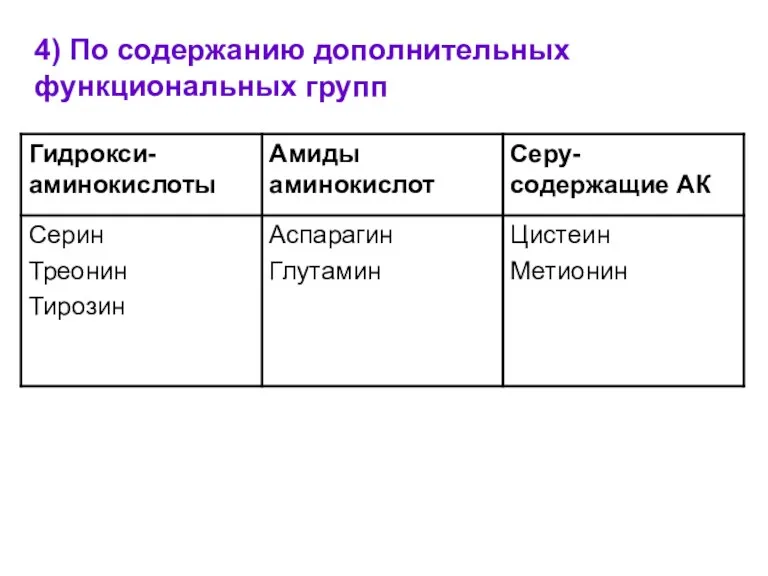
- 10. 4) По содержанию дополнительных функциональных групп
- 11. 5) Биологическая классификация
- 12. Свойства аминокислот
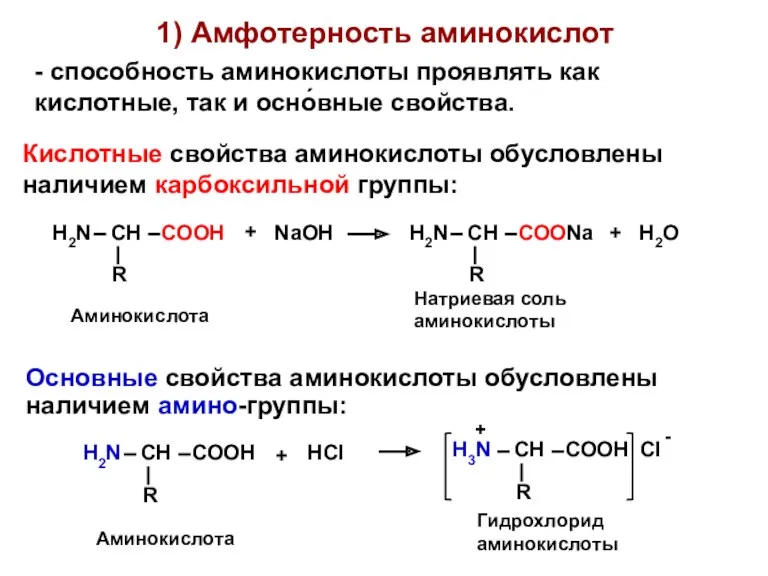
- 13. 1) Амфотерность аминокислот Основные свойства аминокислоты обусловлены наличием амино-группы: - способность аминокислоты проявлять как кислотные, так
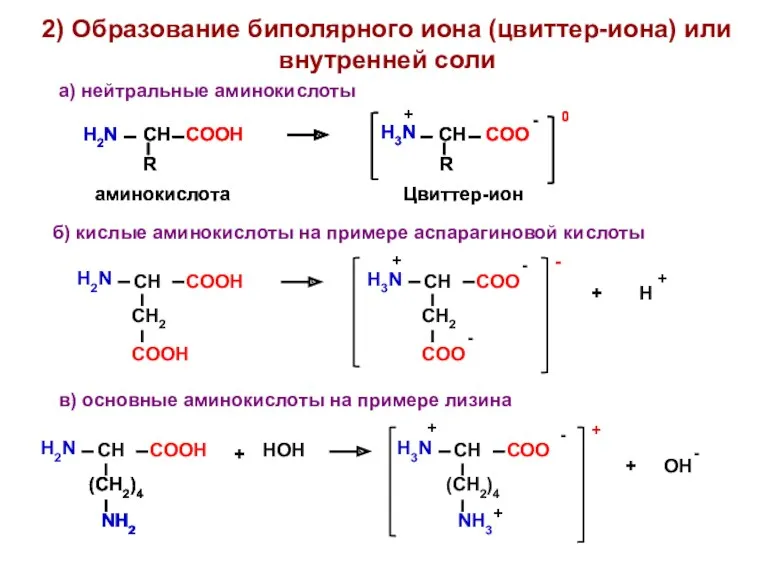
- 14. 2) Образование биполярного иона (цвиттер-иона) или внутренней соли а) нейтральные аминокислоты - + НОН б) кислые
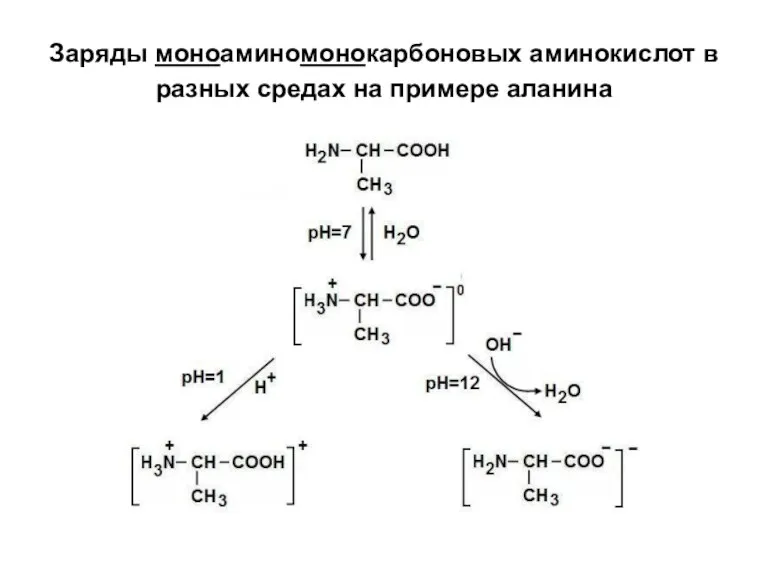
- 15. Заряды моноаминомонокарбоновых аминокислот в разных средах на примере аланина
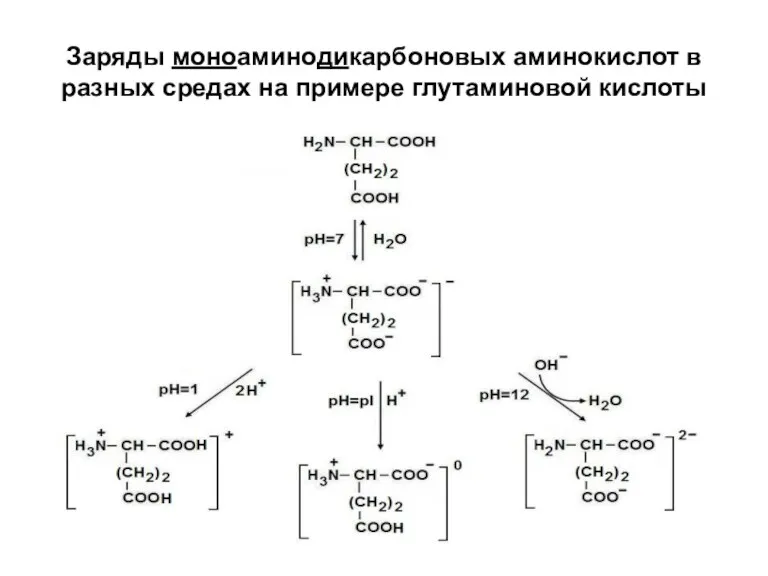
- 16. Заряды моноаминодикарбоновых аминокислот в разных средах на примере глутаминовой кислоты
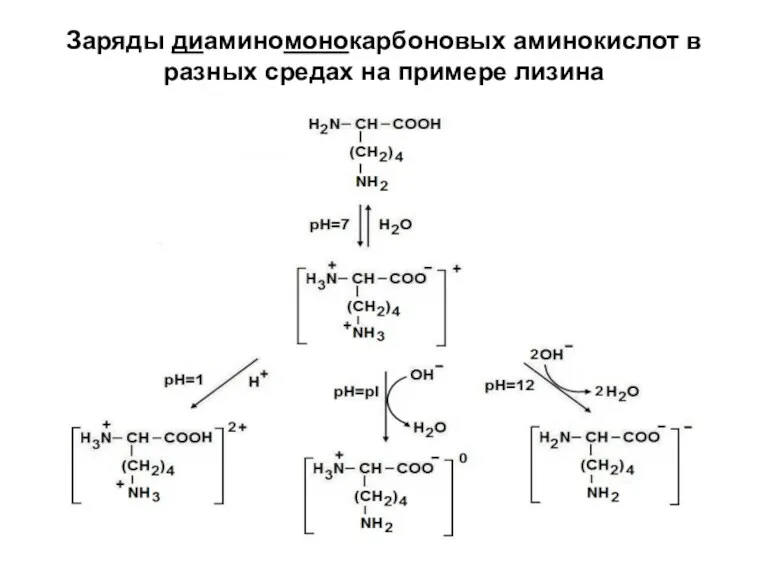
- 17. Заряды диаминомонокарбоновых аминокислот в разных средах на примере лизина
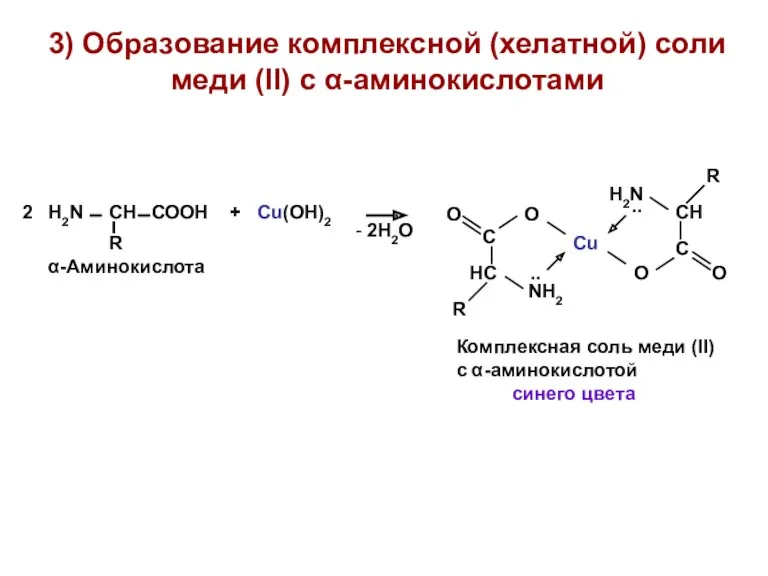
- 18. 3) Образование комплексной (хелатной) соли меди (II) с α-аминокислотами синего цвета
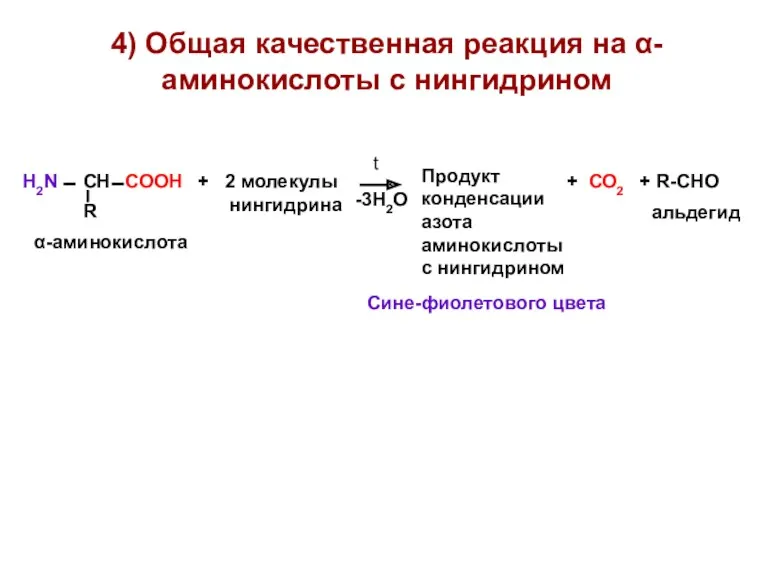
- 19. 4) Общая качественная реакция на α-аминокислоты с нингидрином
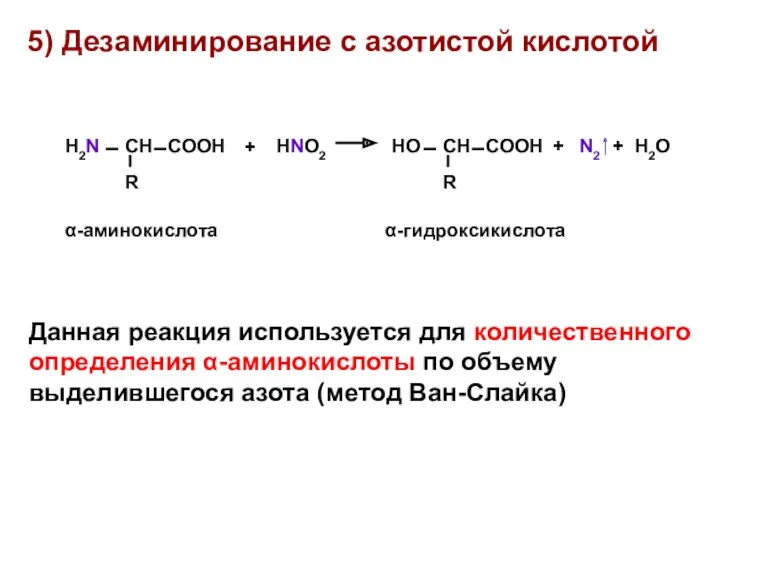
- 20. 5) Дезаминирование с азотистой кислотой Данная реакция используется для количественного определения α-аминокислоты по объему выделившегося азота
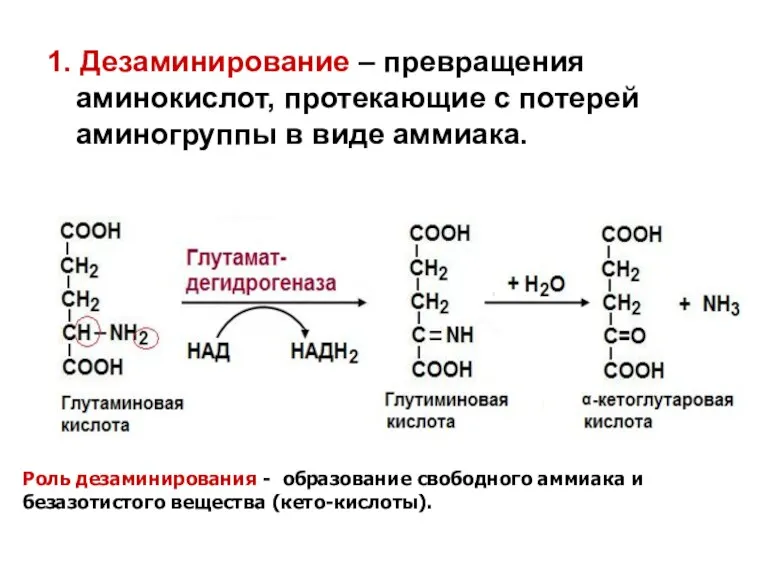
- 21. Общие пути превращения аминокислот в организме животных и человека 1. Дезаминирование 2. Трансаминирование 3. Декарбоксилирование
- 22. 1. Дезаминирование – превращения аминокислот, протекающие с потерей аминогруппы в виде аммиака. Роль дезаминирования - образование
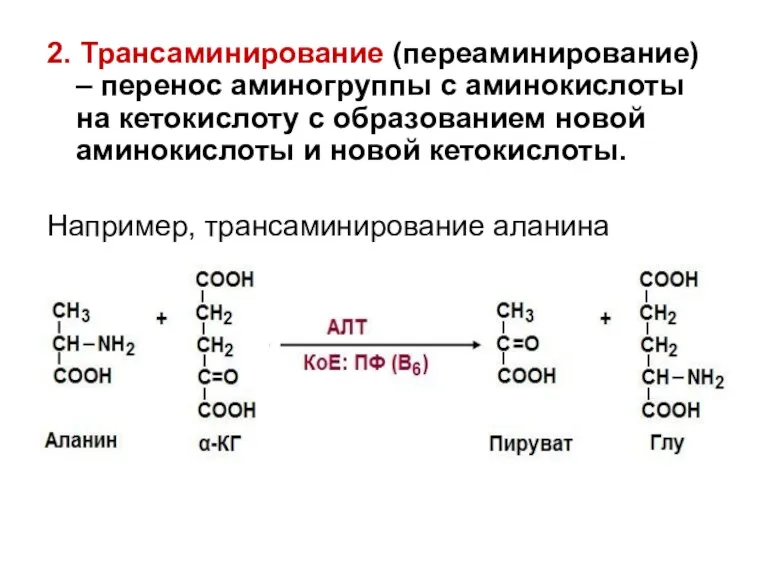
- 23. 2. Трансаминирование (переаминирование) – перенос аминогруппы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой
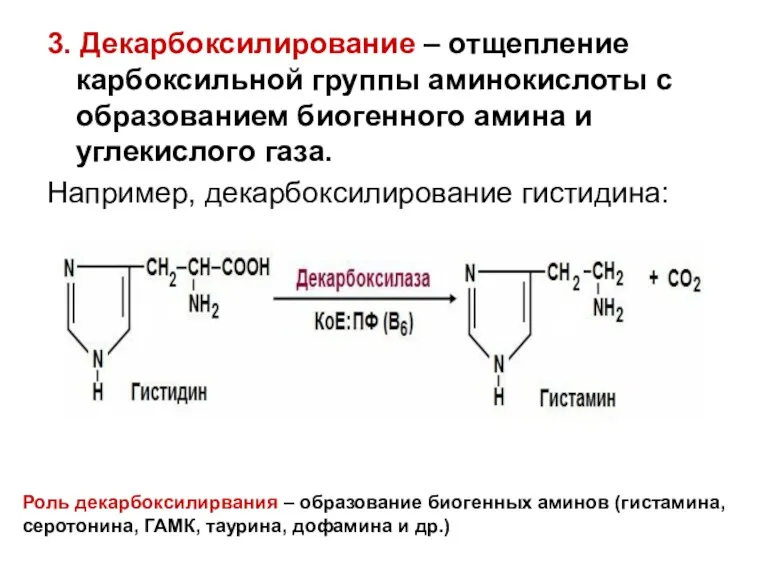
- 24. 3. Декарбоксилирование – отщепление карбоксильной группы аминокислоты с образованием биогенного амина и углекислого газа. Например, декарбоксилирование
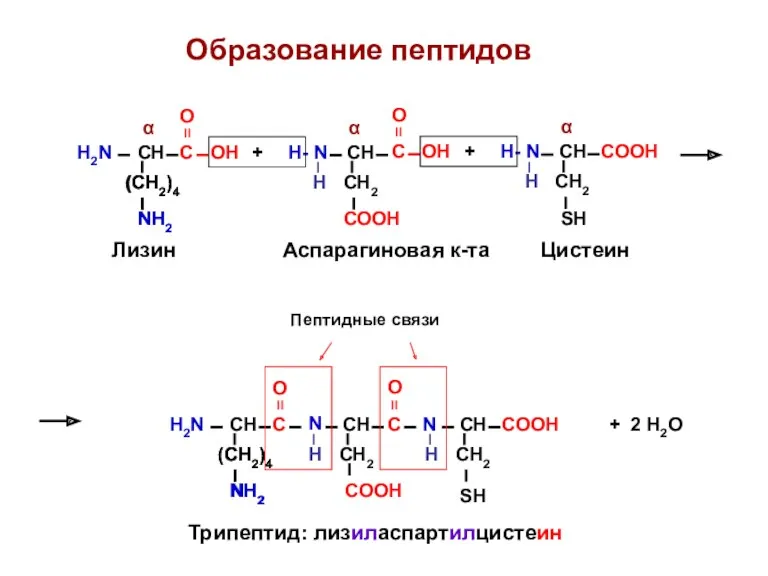
- 25. Пептиды - это органические вещества, содержащие в своем составе от 2 до 10 аминокислотных остатка, соединенных
- 26. Образование пептидов H2N СН + 2 Н2О (СН2)4 NН2 (СН2)4 NН2 α С = О ОН
- 27. Белки – высокомолекулярные азотсодержащие биополимеры (полипептиды), построенные из α-аминокислот, соединенных друг с другом при помощи пептидных
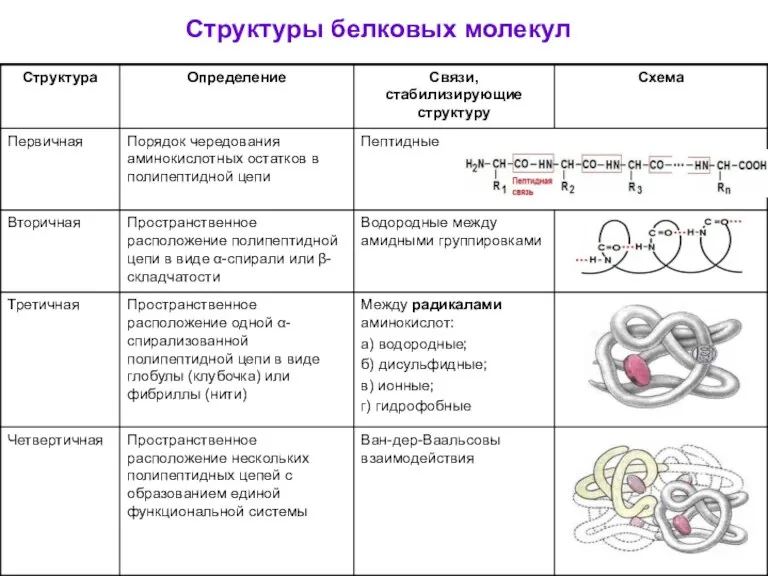
- 28. Строение белковых молекул Первичная структура белка уникальна и детерминирована генетически придает белку видовую специфичность определяет дальнейшую
- 29. Секвенирование – определение первичной структуры белка путем последовательного отщепления α-аминокислот с N-конца полипептида по методу Эдмана.
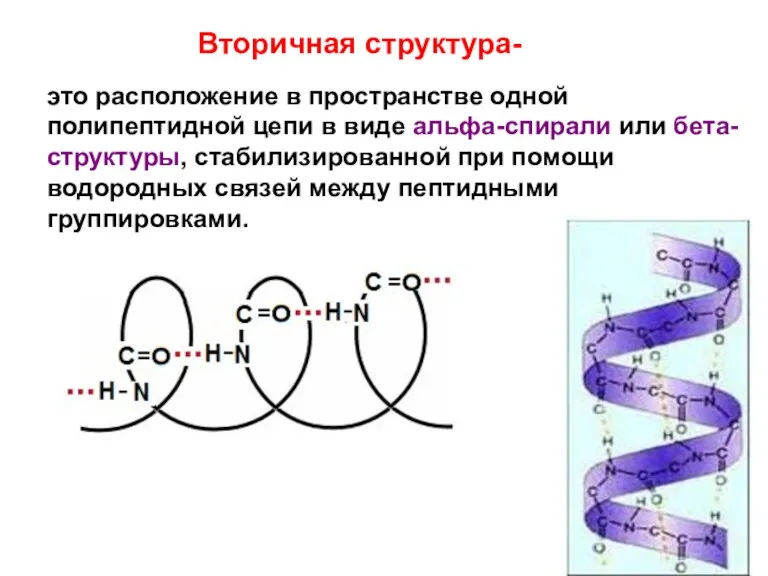
- 30. Вторичная структура- это расположение в пространстве одной полипептидной цепи в виде альфа-спирали или бета-структуры, стабилизированной при
- 31. Третичная структура - это расположение в пространстве одной полипептидной цепи, стабилизированной связями между радикалами аминокислот: водородными,
- 32. Четвертичная структура- Это расположение в пространстве нескольких полипептидных цепей, соединенных между собой нековалентными межрадикальными связями. В
- 33. Структуры белковых молекул
- 34. Физико-химические свойства белков Наличие высокой молекулярной массы (>5000 Да) Амфотерность - обусловлена наличием свободных амино- и
- 35. 3) Изоэлектрическая точка (рI) – значение рН раствора, при котором суммарный заряд молекулы белка равен нулю,
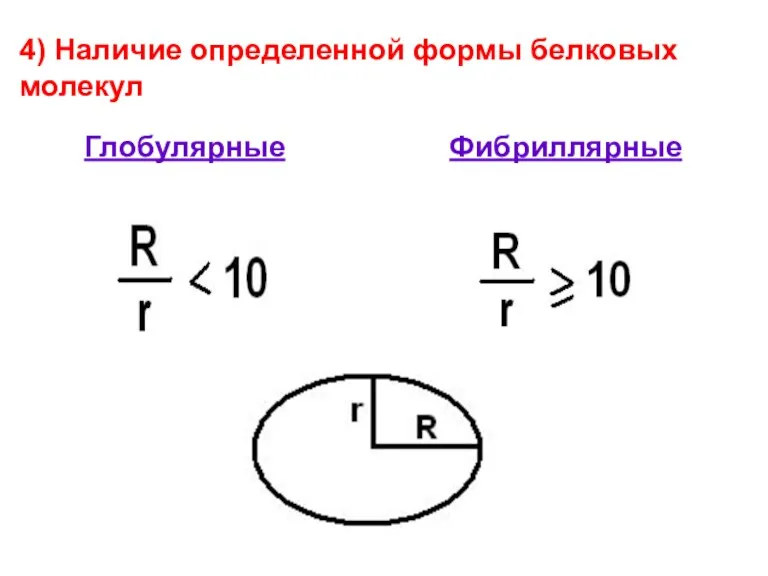
- 36. Глобулярные Фибриллярные 4) Наличие определенной формы белковых молекул
- 37. 5) Растворимость в воде Факторы, стабилизирующие белки в растворе: а) заряд молекулы б) гидратная оболочка Растворимость
- 38. 6) осаждаемость Необратимое осаждение (денатурация) Денатурация – любое негидролитическое нарушение уникальной структуры белка, приводящее к потере
- 39. Классификация белков Простые - при гидролизе дают только аминокислоты Альбумины и глобулины (белки крови) Протамины и
- 40. Функции белков Структурная (коллаген, эластин, кератин) Сократительная (актин, миозин и др.) Транспортная (альбумины, глобулины, трансферрин и
- 42. Скачать презентацию
















 Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Циклоалканы
Циклоалканы Кристаллические решетки
Кристаллические решетки Свойства моторных топлив
Свойства моторных топлив Железо. Физические свойства
Железо. Физические свойства Будова атома: ядро й електронна оболонка. Склад атомних ядер. Протонне та нуклонне число
Будова атома: ядро й електронна оболонка. Склад атомних ядер. Протонне та нуклонне число Мартенситное превращение
Мартенситное превращение Бор, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Бор, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Химический состав клетки
Химический состав клетки Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека История развития промышленности переработки полимеров
История развития промышленности переработки полимеров Сложные эфиры
Сложные эфиры 20191107_binarnye_oksidy_1
20191107_binarnye_oksidy_1 Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Углерод и его соединения
Углерод и его соединения Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Ртуть. Использование ртути
Ртуть. Использование ртути Метаболизм нуклеотидов
Метаболизм нуклеотидов Комплесные соединения
Комплесные соединения Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Оксиды. Состав, классификация, номенклатура. 8 класс
Оксиды. Состав, классификация, номенклатура. 8 класс Количество вещества
Количество вещества Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Полиметилметакрилат
Полиметилметакрилат Нафта. Класифікація нафти
Нафта. Класифікація нафти Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)
Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)