Содержание
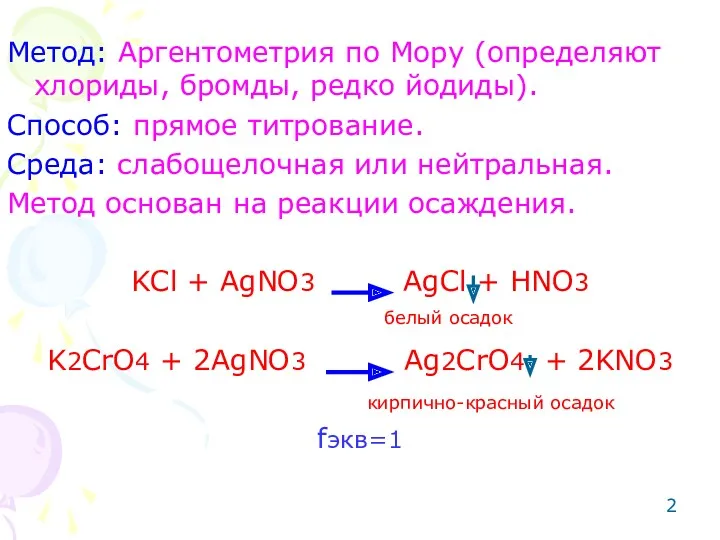
- 2. Метод: Аргентометрия по Мору (определяют хлориды, бромды, редко йодиды). Способ: прямое титрование. Среда: слабощелочная или нейтральная.
- 3. Сущность: точную навеску препарата растворяют в воде и титруют титрованным раствором азотнокислого серебра в точке эквивалентности
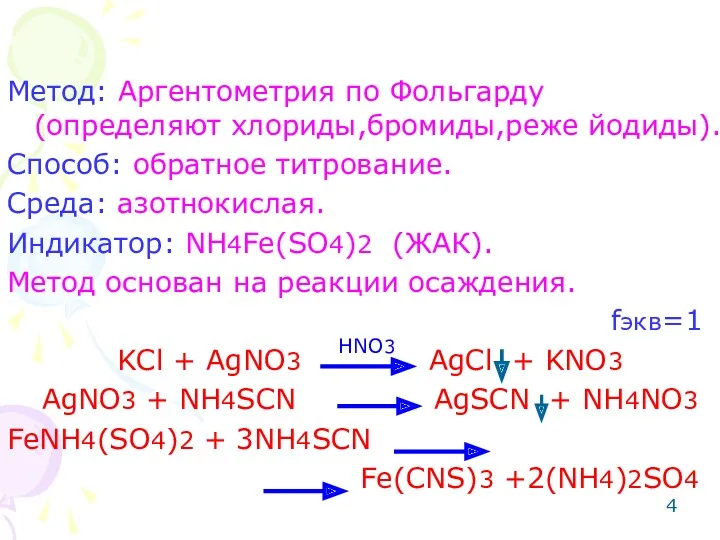
- 4. Метод: Аргентометрия по Фольгарду (определяют хлориды,бромиды,реже йодиды). Способ: обратное титрование. Среда: азотнокислая. Индикатор: NH4Fe(SO4)2 (ЖАК). Метод
- 5. Сущность: Особенность: В сильно-щелочной среде образуется гидроксид серебра, который разлагается до оксида серебра (I), имеющего черный
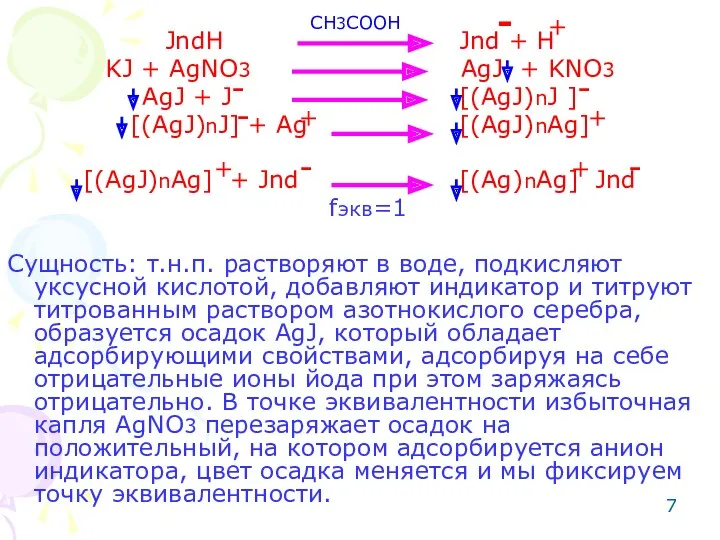
- 6. Метод: Аргентометрия по Фаянсу. (чаще определяют йодиды). Способ: прямое титрование. Среда: уксусно-кислая для полной диссоциации индикатора,
- 7. JndH Jnd + H KJ + AgNO3 AgJ + KNO3 AgJ + J [(AgJ)nJ ] [(AgJ)nJ]
- 8. Метод: Меркуриметрия. Способ: прямое тирование. Среда: азотнокислая. Титрант: раствор нитрата ртути (II). Индикатор: дифенилкарбазон или нитропруссид
- 9. 2KCl + Hg(NO3)2 HgCl2 + 2KNO3 Na2[Fe(CN)5NO] + Hg(NO3)2 2NaNO3 + Hg[Fe(CN)5NO] сулема имидольная форма дифенил
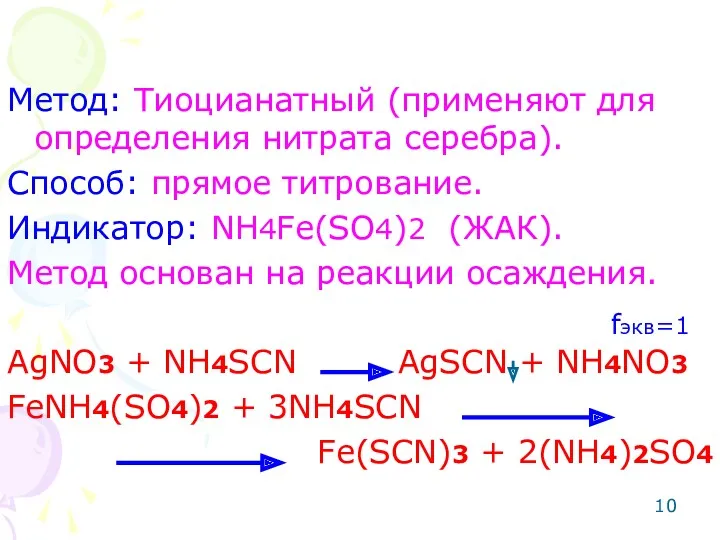
- 10. Метод: Тиоцианатный (применяют для определения нитрата серебра). Способ: прямое титрование. Индикатор: NH4Fe(SO4)2 (ЖАК). Метод основан на
- 11. Препараты, образованные катионами металлов со степенями окисления +2 и +3, определяют количественно Методом комплексонометрическим, способом прямого
- 12. В комплексонометрии применяются металл-индикаторы. Требования к индикаторам: Обратимое взаимодействие металла с индикатором. Связь Ме-Jnd должна быть
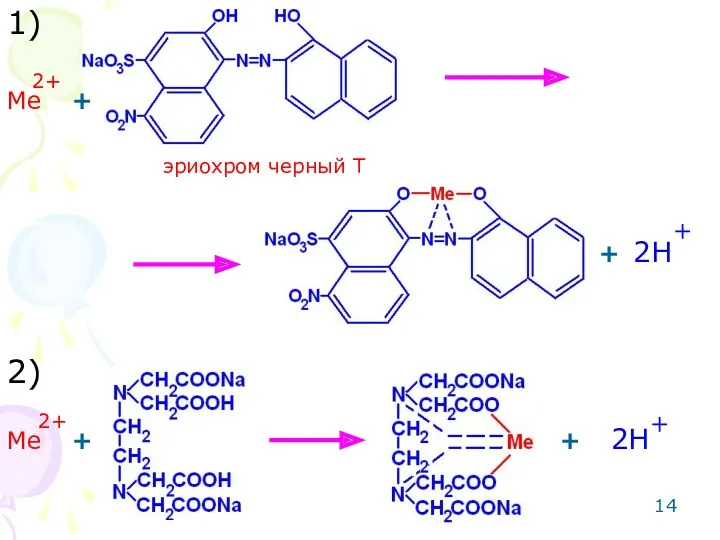
- 13. Метод: комплексонометрический для 2-х зарядных катионов металлов (Zn,Ca,Mg). Способ: прямое титрование. Среда: аммиачный буферный раствор. Титрант:
- 14. Ме 2+ Ме 2+ + + + + 2H 2H + + 1) 2) эриохром черный
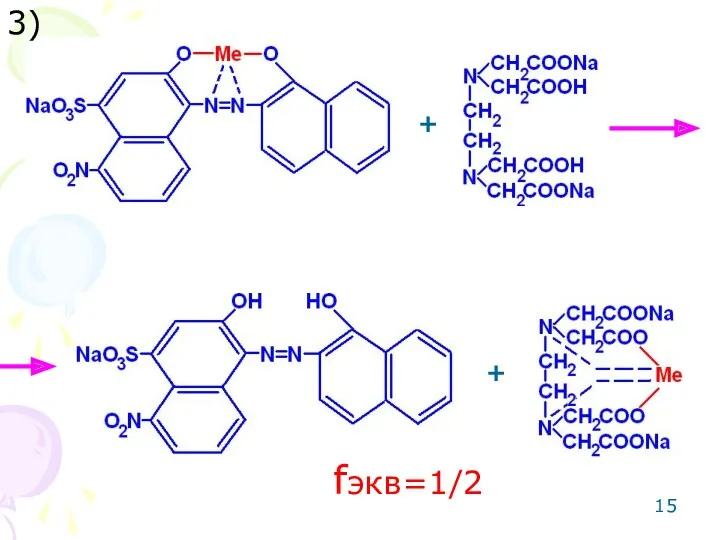
- 15. 3) + + fэкв=1/2
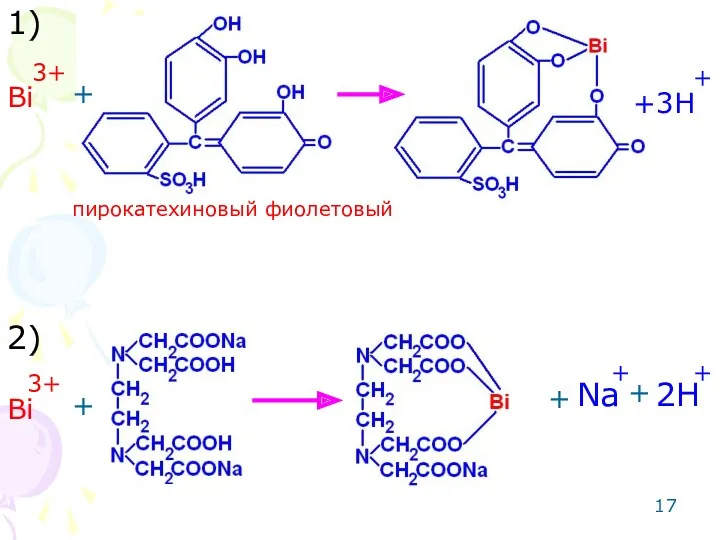
- 16. Метод: комплексонометрический для 3-х зарядных катионов металлов (Bi ). Способ: прямое титрование. Среда: азотнокислая. Титрант: раствор
- 17. Bi 3+ +3H + + + + + + + Bi 3+ Na 2H 1) 2)
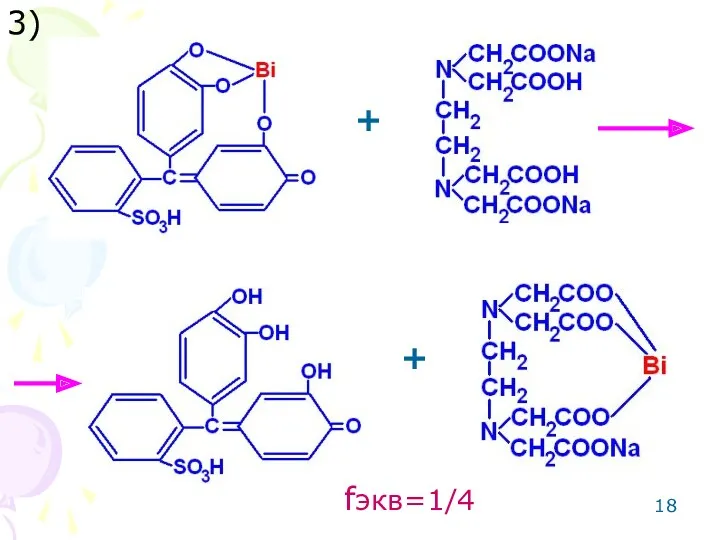
- 18. 3) + + fэкв=1/4
- 19. Метод: комплексонометрический. Способ: обратное титрование (для определения FeSO4 и CuSO4). Индикатор: эриохром черный Т Обратное титрование
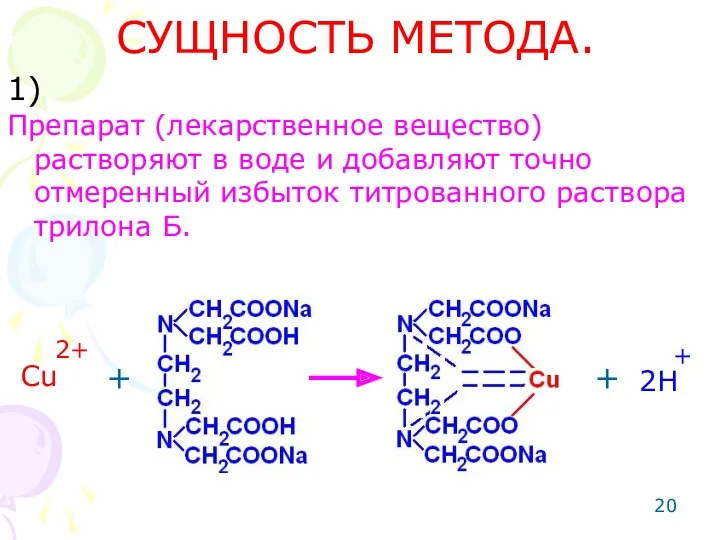
- 20. СУЩНОСТЬ МЕТОДА. Препарат (лекарственное вещество) растворяют в воде и добавляют точно отмеренный избыток титрованного раствора трилона
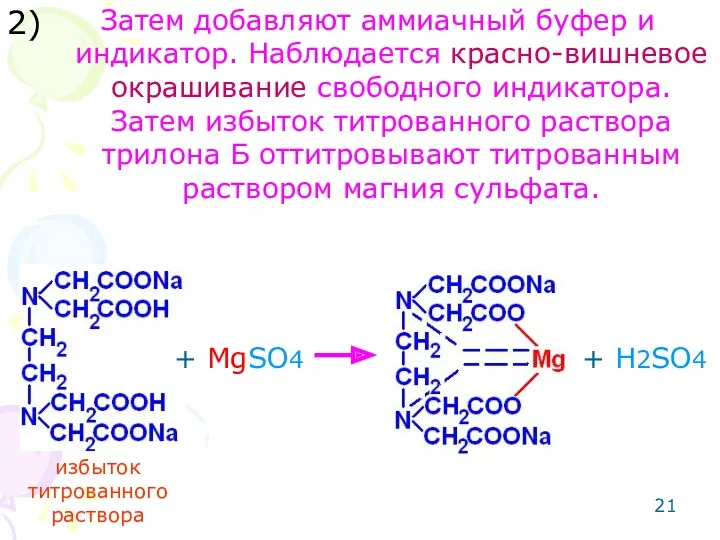
- 21. Затем добавляют аммиачный буфер и индикатор. Наблюдается красно-вишневое окрашивание свободного индикатора. Затем избыток титрованного раствора трилона
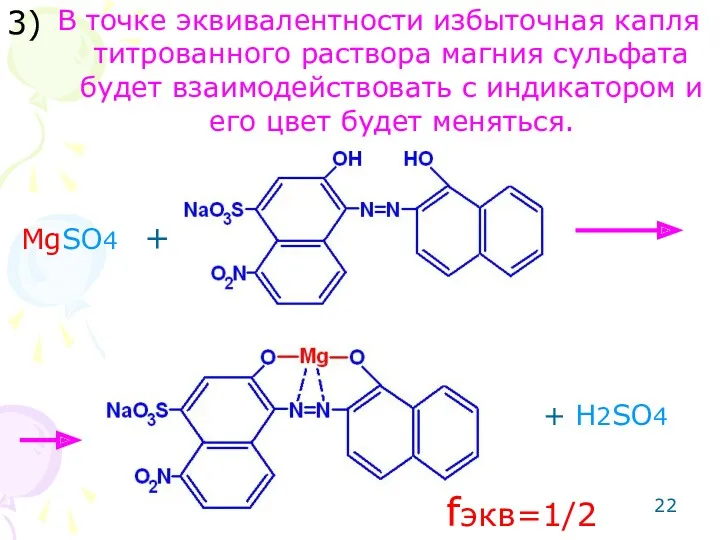
- 22. В точке эквивалентности избыточная капля титрованного раствора магния сульфата будет взаимодействовать с индикатором и его цвет
- 23. ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ И ФОРМАЛЬДЕГИДА Метод: йодометрический. Способ: обратное титрование. Среда: щелочная (т.к. альдегидная группа окисляется йодом
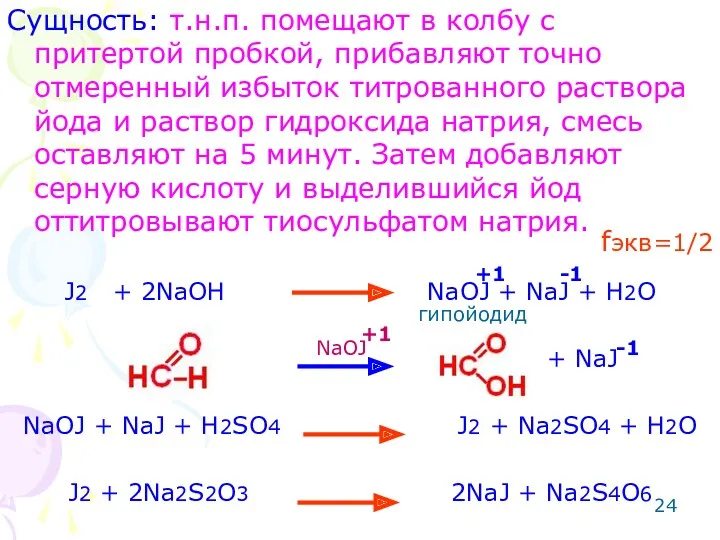
- 24. Сущность: т.н.п. помещают в колбу с притертой пробкой, прибавляют точно отмеренный избыток титрованного раствора йода и
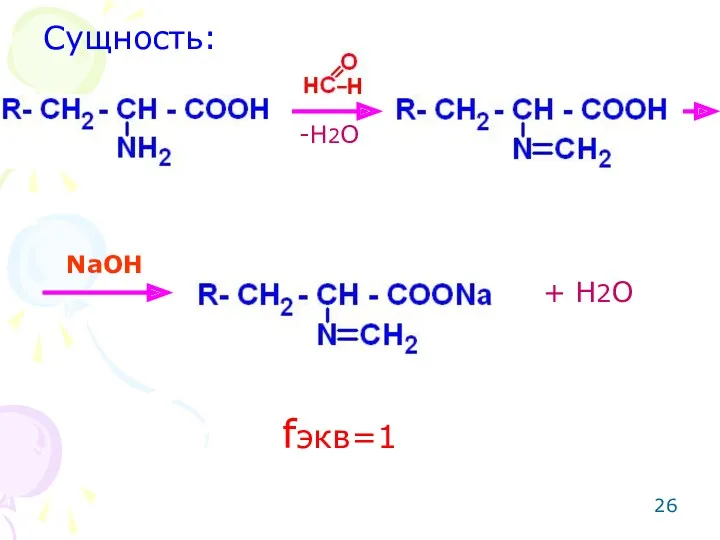
- 25. ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТ Метод: алкалиметрический по Сиренсу с блокировкой первичной алифатической аминогруппы формальдегидом с целью усиления кислотных
- 26. Сущность: -H2O NaOH + H2O fэкв=1
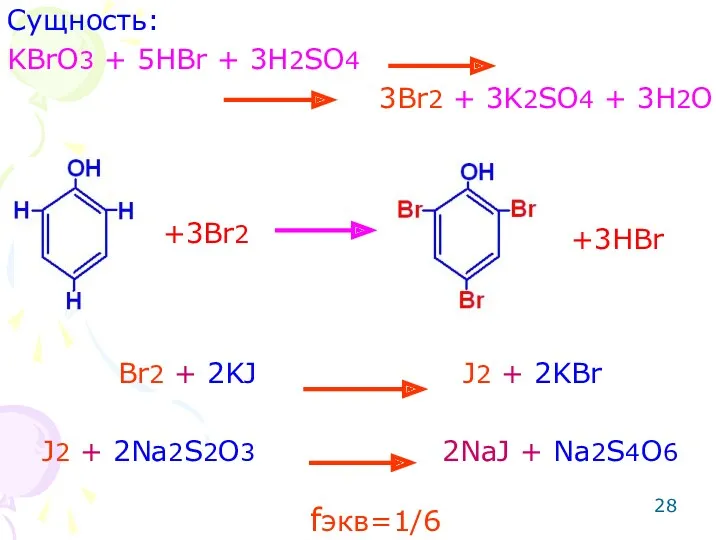
- 27. ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: броматометрический. Способ: обратное титрование. Метод основан на реакции электрофильного замещения.
- 28. Сущность: KBrO3 + 5HBr + 3H2SO4 3Br2 + 3K2SO4 + 3H2O Br2 + 2KJ J2 +
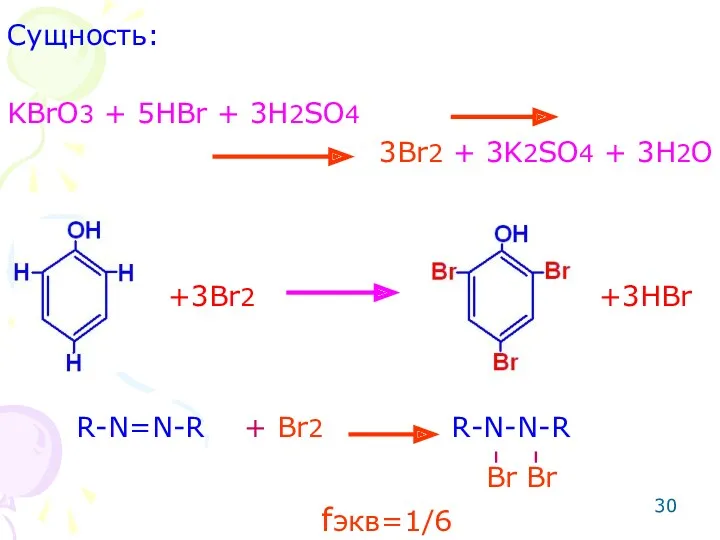
- 29. ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: броматометрический. Способ: прямое титрование. Индикатор: метиловый красный. Метод основан на реакции электрофильного замещения.
- 30. Сущность: KBrO3 + 5HBr + 3H2SO4 3Br2 + 3K2SO4 + 3H2O R-N=N-R + Br2 R-N-N-R +3Br2
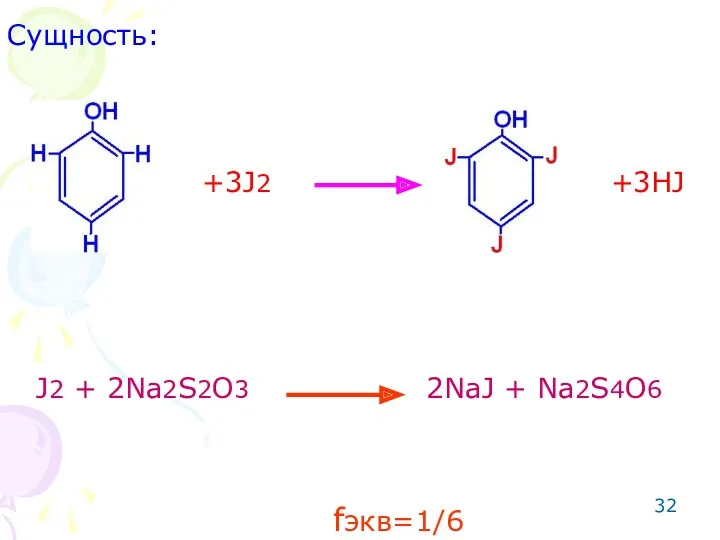
- 31. ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: йодометрический. Способ: обратное титрование. Метод основан на реакции электрофильного замещения
- 32. Сущность: J2 + 2Na2S2O3 2NaJ + Na2S4O6 +3J2 +3HJ fэкв=1/6
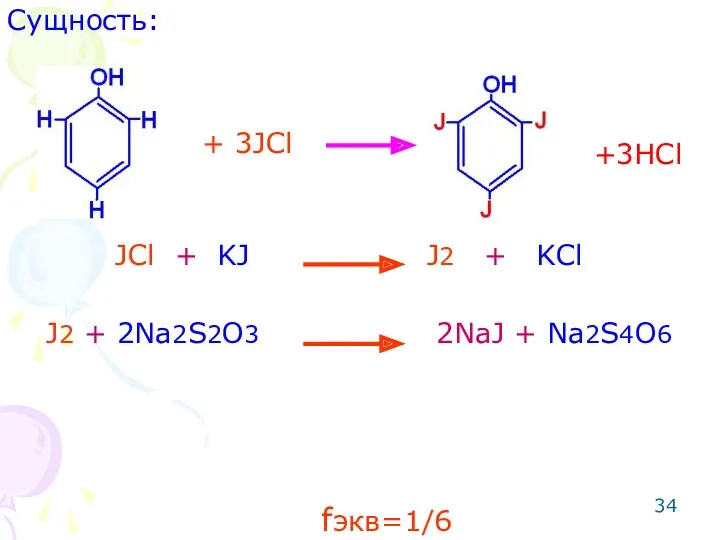
- 33. ОПРЕДЕЛЕНИЕ ФЕНОЛОВ Метод: хлорйодометрический. Способ: обратное титрование. Метод основан на реакции электрофильного замещения.
- 34. Сущность: JCl + KJ J2 + KCl J2 + 2Na2S2O3 2NaJ + Na2S4O6 + 3JCl +3HCl
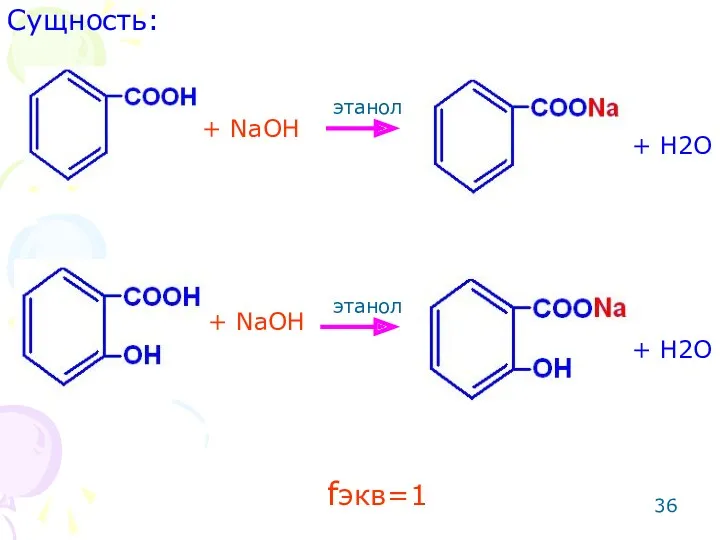
- 35. ОПРЕДЕЛЕНИЕ БЕНЗОЙНОЙ И САЛИЦИЛОВОЙ КИСЛОТ Метод: алкалиметрический. Способ: прямое титрование. Среда: этанол (для лучшего растворения навески
- 36. + NaOH + NaOH + H2O + H2O fэкв=1 этанол этанол Сущность:
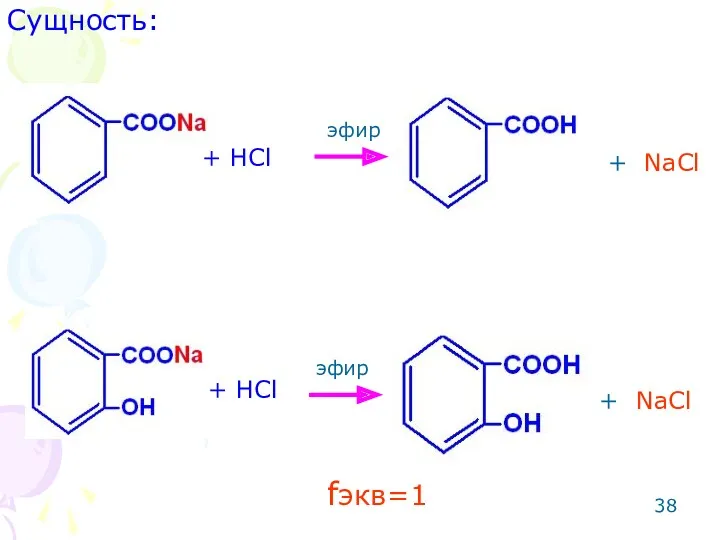
- 37. ОПРЕДЕЛЕНИЕ СОЛЕЙ БЕНЗОЙНОЙ И САЛИЦИЛОВОЙ КИСЛОТ Метод: ацидиметрический. Способ: прямое титрование. Среда: эфир (для извлечения из
- 38. Сущность: + NaCl + NaCl + HCl + HCl эфир эфир fэкв=1
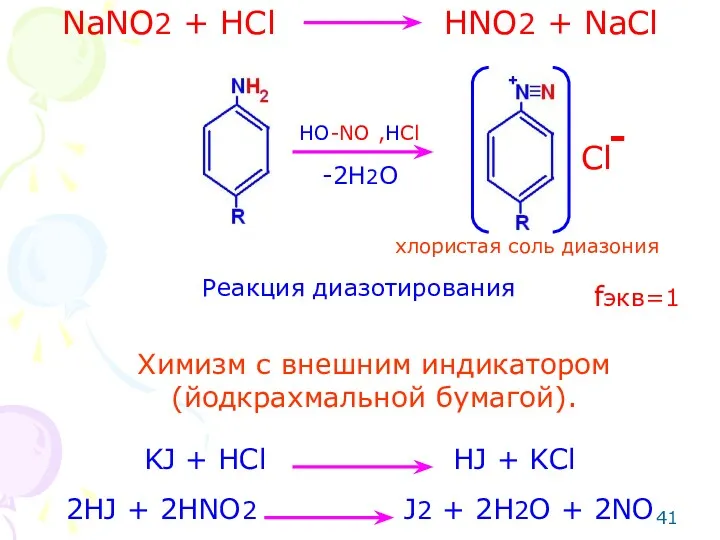
- 39. Метод: нитритометрия (по первичной ароматической аминогруппе- для бензокаина, прокаина, прокаинамида, метоклопрамида, сульфаниламидных препаратов). Способ: прямое титрование.
- 40. Особенности: добавляют катализатор (калия бромид), т.к. реакция идет медленно. Реакцию проводят на холоду, т.к. при температуре
- 41. NaNO2 + HCl HNO2 + NaCl HO-NO ,HCl Cl - -2H2O хлористая соль диазония Реакция диазотирования
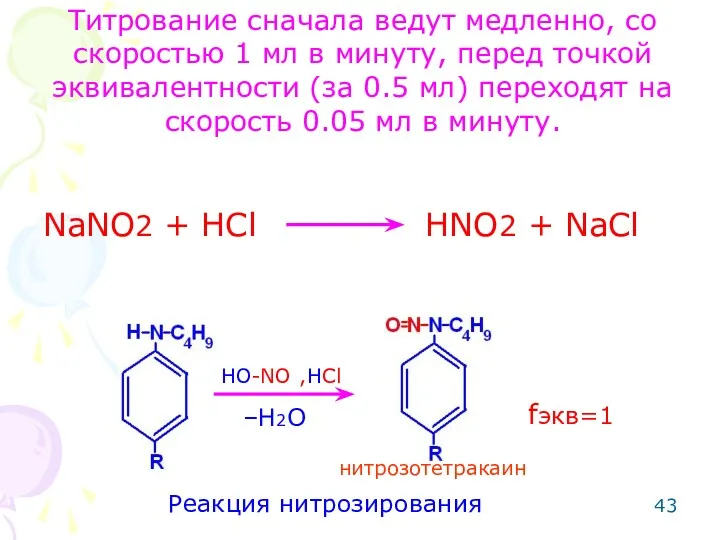
- 42. Метод: нитритометрия (по вторичной ароматической аминогруппы – для тетракаина гидрохлорида). Способ: прямое тирование. Метод основан на
- 43. NaNO2 + HCl HNO2 + NaCl Реакция нитрозирования –H2O HO-NO ,HCl нитрозотетракаин fэкв=1 Титрование сначала ведут
- 44. ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ СО СЛАБО-ОСНОВНЫМИ СВОЙСТВАМИ Метод: неводное титрование. Способ: прямое титрование. Титрант: хлорная кислота. Среда:
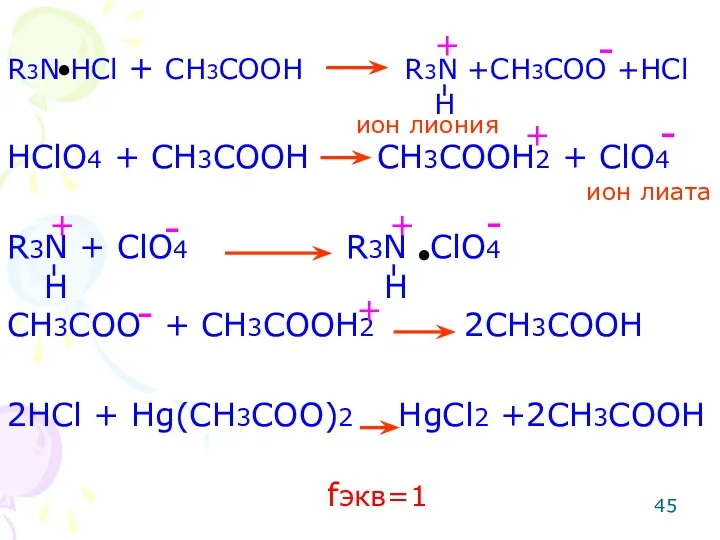
- 45. R3N HCl + CH3COOH R3N +CH3COO +HCl HClO4 + CH3COOH CH3COOH2 + ClO4 R3N + ClO4
- 46. ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ СО СЛАБО-КИСЛОТНЫМИ СВОЙСТВАМИ Метод: неводное титрование. Способ: прямое титрование. Титрант: метилат натрия. Среда:
- 48. Скачать презентацию




![2KCl + Hg(NO3)2 HgCl2 + 2KNO3 Na2[Fe(CN)5NO] + Hg(NO3)2 2NaNO3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216316/slide-8.jpg)


















 Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов Азот и его соединения. История открытия
Азот и его соединения. История открытия Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)
Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1) Классификация химических реакций
Классификация химических реакций Современные представления о катализе. Общие закономерности гетерогенного катализа
Современные представления о катализе. Общие закономерности гетерогенного катализа Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ
Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Основные классы неорганических соединений
Основные классы неорганических соединений Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Теория электролитической диссоциации
Теория электролитической диссоциации Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Композиты и композиционные материалы
Композиты и композиционные материалы Зелёные камни
Зелёные камни Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Простые вещества металлы
Простые вещества металлы Электролиз. Электролиз раствора и электролиз расплава электролита
Электролиз. Электролиз раствора и электролиз расплава электролита a27156dfd11d4f939d9a0cf3023d54c5
a27156dfd11d4f939d9a0cf3023d54c5 Общие свойства металлов
Общие свойства металлов Периодическая система Д.И. Менделеева и строение атома
Периодическая система Д.И. Менделеева и строение атома Серная кислота и ее соли
Серная кислота и ее соли Формы выделения минералов
Формы выделения минералов Азотная кислота
Азотная кислота Методи добування у промисловості
Методи добування у промисловості Химические свойства алкенов
Химические свойства алкенов