Содержание
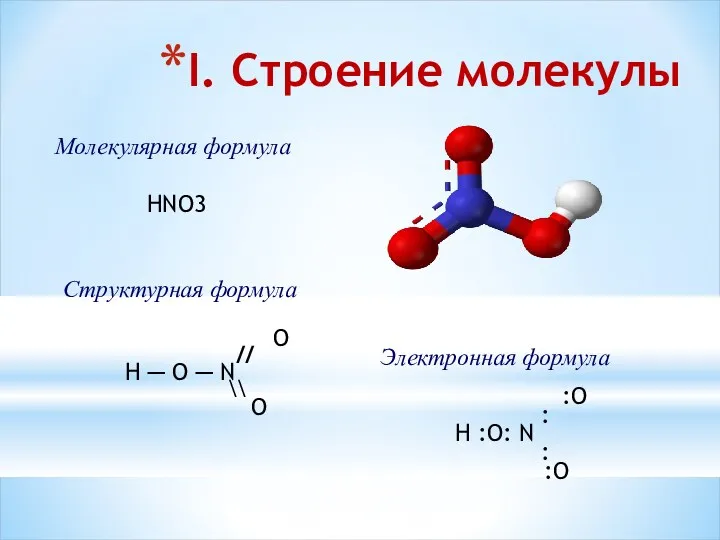
- 2. I. Строение молекулы Молекулярная формула HNO3 Электронная формула :O : H :O: N : :O Структурная
- 3. По основности: одноосновная По содержанию «О»: кислородсодержащая По растворимости в воде: растворимая По стабильности: нестабильная По
- 4. Физические свойства: Ж., едкий з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С
- 5. Химические свойства: I. Общие с другими кислотами 1. Диссоциация_Сильный электролит, изменяет окраску индикаторов НNO3 + лакмус
- 6. 2. С основными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ + 2NO3-
- 7. 3.С основаниями (нерастворимыми): Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H++ 2NO 3- =
- 8. 4. С растворимыми основаниями NaOH + HNO3 = NaNO3+ H2O Na+ + OH - + H+
- 9. C солями (более слабых кислот): Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O 2Na+ + CO32
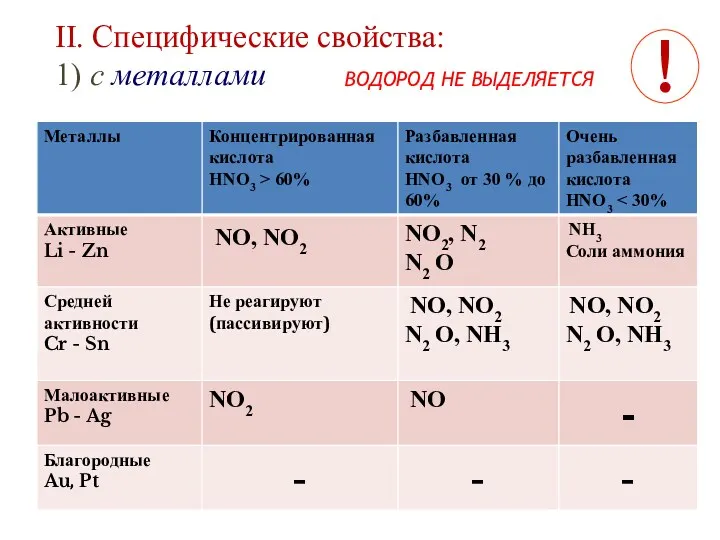
- 10. II. Cпецифические свойства: 1) с металлами ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ !
- 11. Схема уравнения Ме +HNO3 = соль + вода + оксиды азота (нитрат Ме) (аммиак, соли аммония)
- 12. 4HNO3 = 4 NO2 + 2 H2O + O2. 2)при нагревании и под действием света разлагается
- 13. Азотная кислота – сильный окислитель, реагирует с простыми веществами: 2HNO3(конц.) + S -> H2SO4 + 2NO↑
- 14. Получение ГЛАУБЕР Иоганн Рудольф (1604-1670), немецкий химик и врач. Получил чистую азотную кислоту в 1650 году.
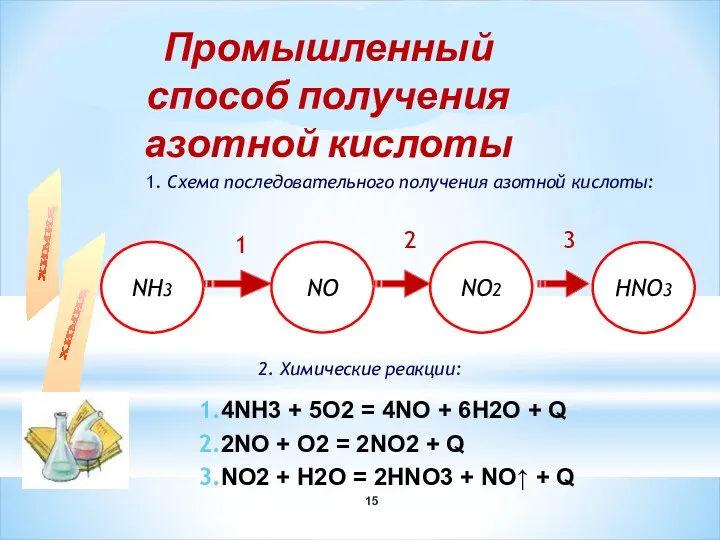
- 15. 1. Схема последовательного получения азотной кислоты: Промышленный способ получения азотной кислоты 2. Химические реакции: 1 2
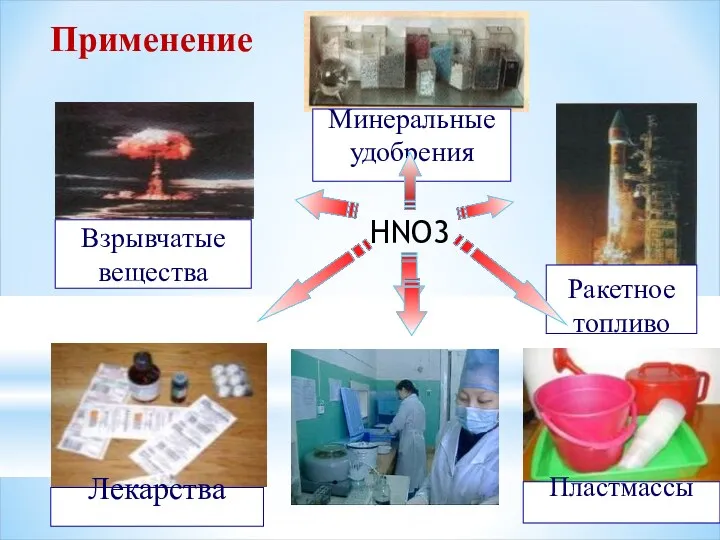
- 16. Применение HNO3
- 17. Согласны ли вы со следующими утверждениями: ? 1. Азотная кислота является сильным окислителем. 2. Азотная кислота
- 18. ПРОВЕРЬ СЕБЯ ! 1. Да 2. Нет 3. Да 4. Нет 5. Нет 6. Да 7.
- 20. Скачать презентацию













 Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах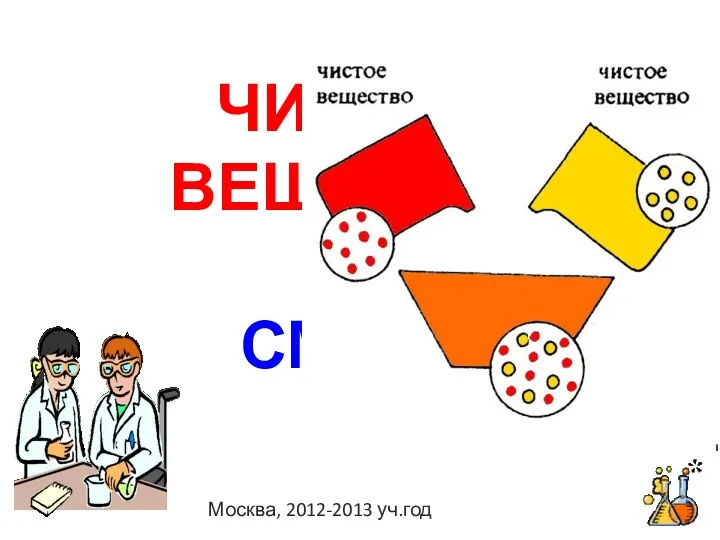 Чистые вещества и смеси
Чистые вещества и смеси Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості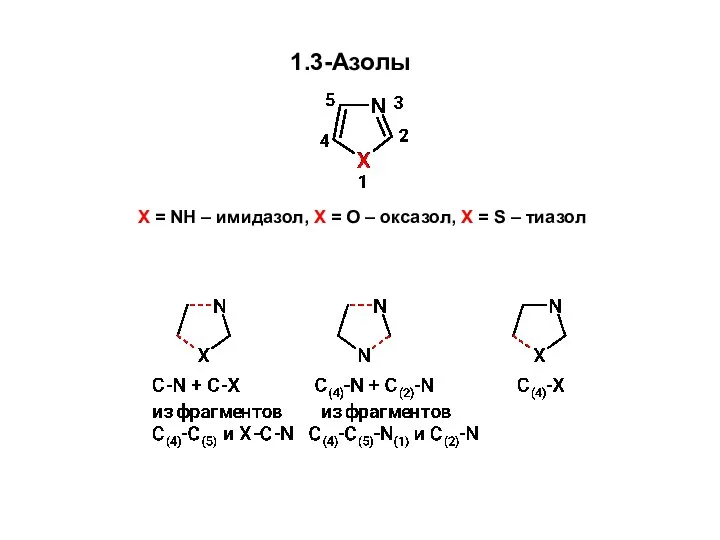 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Аммиак. Соли аммония
Аммиак. Соли аммония Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Автомобильные масла. Классификация и применение автомобильных масел
Автомобильные масла. Классификация и применение автомобильных масел Нітрати – токсичні речовини
Нітрати – токсичні речовини Исследование модифицирования на структуру и жидкотекучесть сплава АК12
Исследование модифицирования на структуру и жидкотекучесть сплава АК12 Распространение пламени в газах
Распространение пламени в газах Химические свойства металлов
Химические свойства металлов Виды химической связи
Виды химической связи Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Stirring in liquid media
Stirring in liquid media Строение атома
Строение атома Бензол. Чикишев С. (2)
Бензол. Чикишев С. (2) Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Углерод и его оксиды
Углерод и его оксиды Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Многообразие карбоновых кислот
Многообразие карбоновых кислот Механизмы органических реакций
Механизмы органических реакций Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их Азот и его соединения
Азот и его соединения Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия 20230419_azot
20230419_azot