Содержание
- 2. Проблема. «Безжизненный» Элемент жизни
- 3. Историческая справка. В 1772 году выделен из воздуха Даниэлем Резерфордом. Не поддерживал горение, дыхание. В 1787
- 4. Простое вещество. Азот-газ, без цвета, без запаха, легче воздуха, плохо растворим в воде. t(с.)=-195,8; t(зам.)=-210. Входит
- 5. СТРОЕНИЕ МОЛЕКУЛЫ N N N ≡ N СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ
- 6. Химические свойства. Восстановительные. O2 +N2 2NO оксид азота Окислительные. 6Li +N2 =2Li3N нитрид 3H2 +N2 2NH3
- 7. Применение. Для охлаждения. Для создания инертной среды. Получение удобрений.
- 8. Применение жидкого азота В косметологии жидкий азот применяется . для лечения вульгарных, подошвенных и плоских бородавок,
- 9. Поведение веществ в жидком азоте Вещества в жидком азоте становятся хрупкими
- 10. Ожоги жидким азотом Следует охладить поражённые участки тела водой или холодными предметами, ввести обезболивающие препараты, наложить
- 11. Химический элемент. Природные изотопы: 14N(99 ,6%) 15N(0 ,04%) Входит в состав: NaNO3 натриевой(чилийской) селитры, Белков и
- 13. СТРОЕНИЕ И СВОЙСТВА АТОМА 2 период, 5 группа, главная подгруппа Содержит на внешнем энергетическом уровне 5
- 14. Сравнительная характеристика оксидов азота
- 15. Азотная кислота. HNO3 Азотная кислота – бесцветная гигроскопичная жидкость, имеет резкий запах, «дымит» на воздухе, неограниченно
- 16. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 17. Азотная кислота (HNO3) Классификация наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая одноосновная
- 18. Получение азотной кислоты в промышленности NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2
- 19. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. NaNO3 +
- 20. Химические свойства азотной кислоты 1. Типичные свойства кислот 2. Взаимодействие азотной кислоты с металлами 3. Взаимодействие
- 21. Взаимодействие с металлами Концентрированная азотная кислота Me + HNO3(конц.) → соль + вода + NO2 С
- 22. Взаимодействие с металлами Разбавленная азотная кислота Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности
- 23. Взаимодействие азотной кислоты с неметаллами Окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 24. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 25. 1. Число электронов в атоме азота 1) 7 3) 9 2) 14 4) 12 2. Число
- 26. 4. Степень окисления азота в соединениях N2O5, NH3 соответственно равна 1) +2 и -3 3) +5
- 28. Скачать презентацию
 Суды тазарту әдістері
Суды тазарту әдістері Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Химический состав. Закуска
Химический состав. Закуска D-элементы: хром, молибден, вольфрам
D-элементы: хром, молибден, вольфрам Теория сплавов
Теория сплавов Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Дисперсные системы
Дисперсные системы Atomic structure
Atomic structure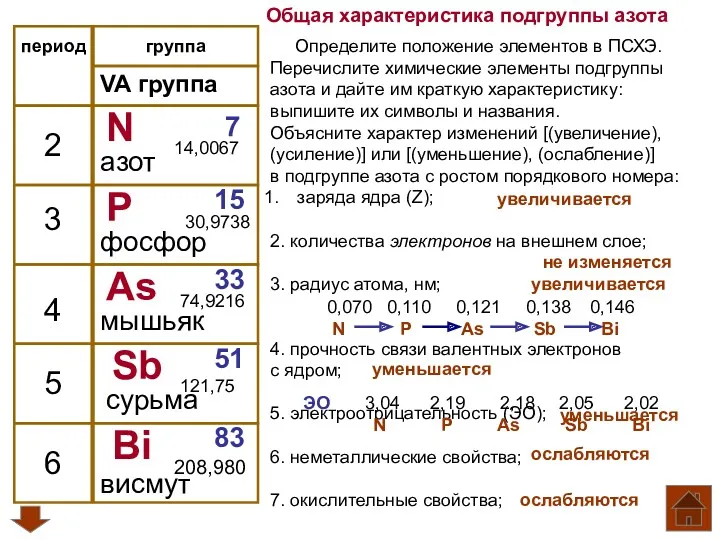 Общая характеристика подгруппы азота
Общая характеристика подгруппы азота Способы переработки нефти
Способы переработки нефти Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Значення хімічних процесів у природі
Значення хімічних процесів у природі Макро, микро и ультрамикроэлементы. Их роль
Макро, микро и ультрамикроэлементы. Их роль Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс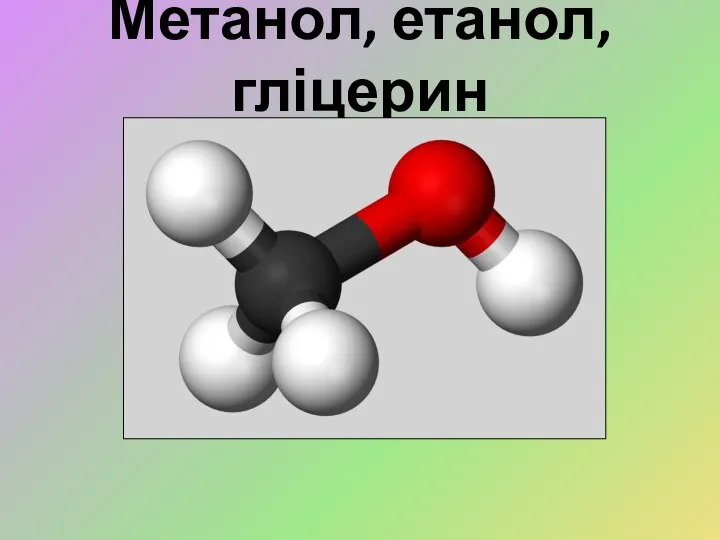 Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле История мыловарения
История мыловарения Синтетический каучук и его применение
Синтетический каучук и его применение Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Ферменттер – тіршілік негізі
Ферменттер – тіршілік негізі Природные и синтетические полимеры
Природные и синтетические полимеры Теория растворов (лекция 2)
Теория растворов (лекция 2) Многоатомные спирты
Многоатомные спирты Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі
Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі