Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для презентация
Содержание
- 2. Применение литий ионный аккумуляторов Литий ионные аккумуляторы распространены на сегодняшний день и уверенно завоёвывают позиции во
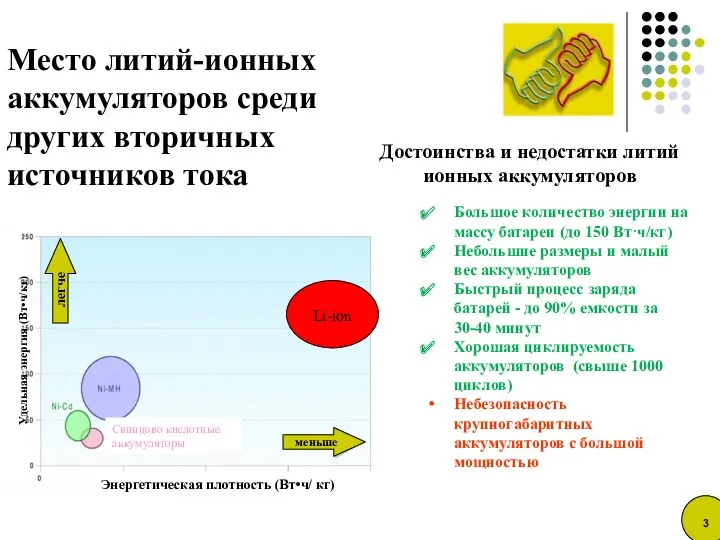
- 3. Достоинства и недостатки литий ионных аккумуляторов Место литий-ионных аккумуляторов среди других вторичных источников тока Удельная энергия
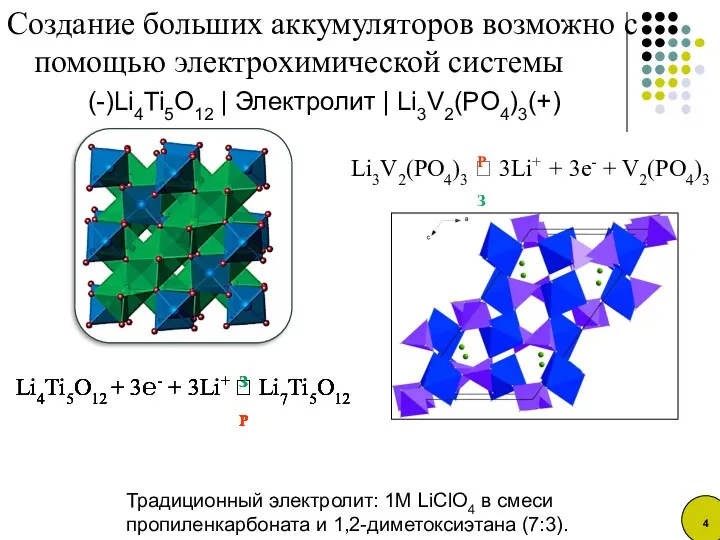
- 4. Создание больших аккумуляторов возможно с помощью электрохимической системы (-)Li4Ti5O12 | Электролит | Li3V2(PO4)3(+) Традиционный электролит: 1M
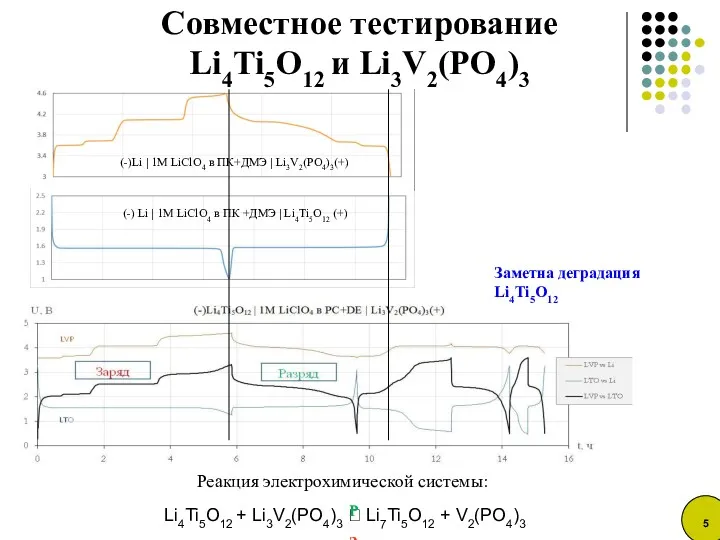
- 5. Совместное тестирование Li4Ti5O12 и Li3V2(PO4)3 (-) Li | 1M LiClO4 в ПК +ДМЭ | Li4Ti5O12 (+)
- 6. Недозаряд анода Li4Ti5O12 на первом цикле Изменение состава электролита: 1. Переход ванадия в электролит 2. Образование
- 7. Цель работы: Установить причину плохой работоспособности электрохимической системы: (-)Li4Ti5O12 | 1M LiClO4 в ПК+ДМЭ| Li3V2(PO4)3(+)
- 8. Методика Электрохимические измерения проводились гальваностатическим методом в трёхэлектродных ячейках Качественный химический состав материалов и электролита определялся
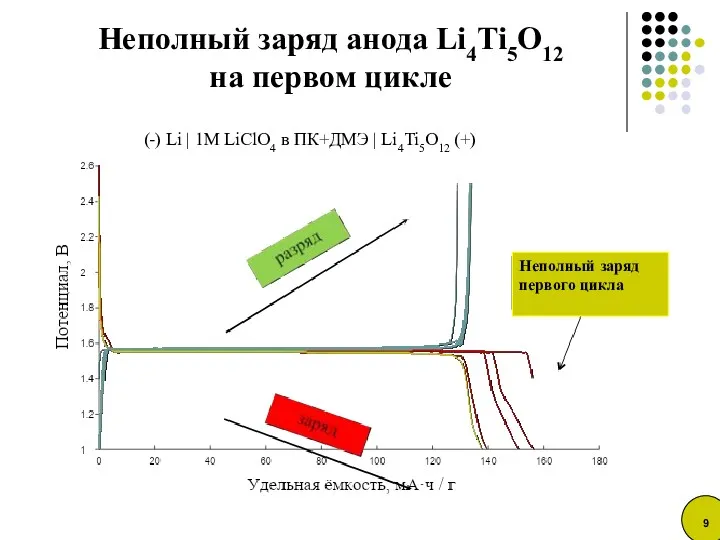
- 9. Неполный заряд анода Li4Ti5O12 на первом цикле Неполный заряд первого цикла (-) Li | 1M LiClO4
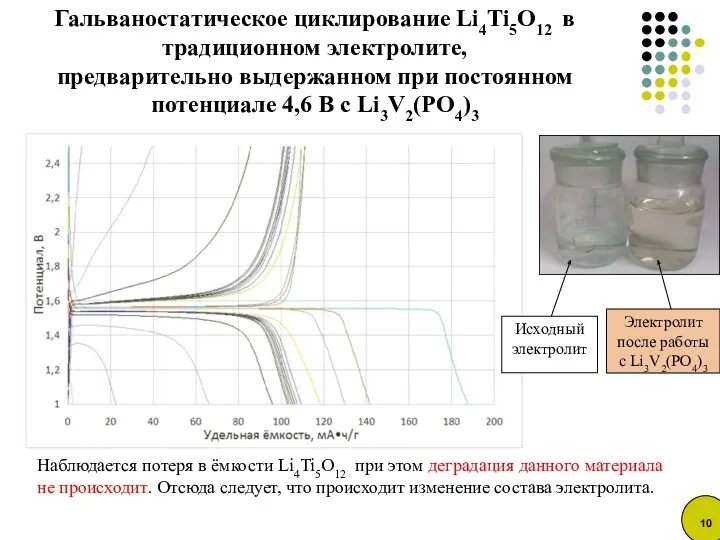
- 10. Гальваностатическое циклирование Li4Ti5O12 в традиционном электролите, предварительно выдержанном при постоянном потенциале 4,6 В с Li3V2(PO4)3 Наблюдается
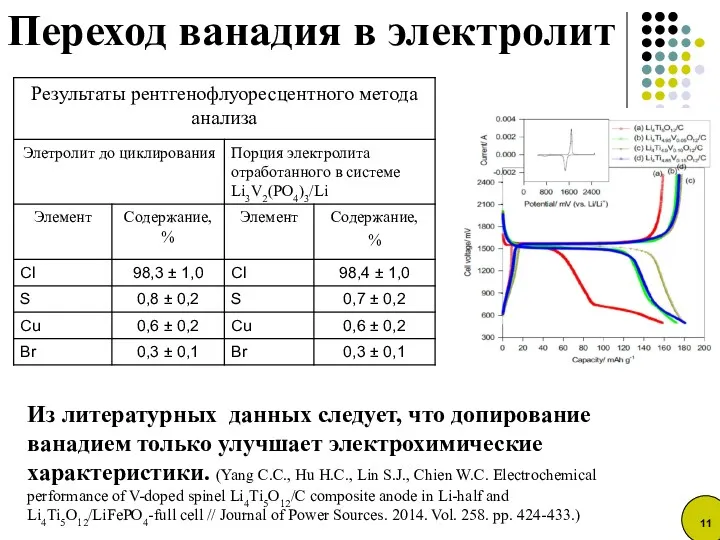
- 11. Из литературных данных следует, что допирование ванадием только улучшает электрохимические характеристики. (Yang C.C., Hu H.C., Lin
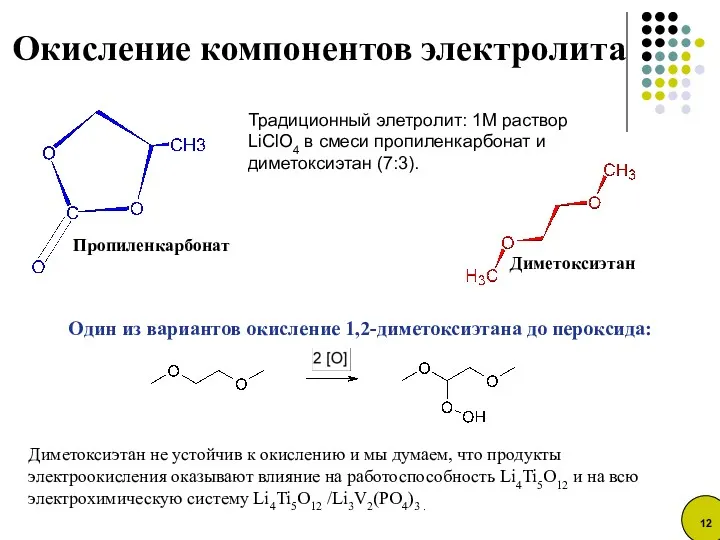
- 12. Традиционный элетролит: 1M раствор LiClO4 в смеси пропиленкарбонат и диметоксиэтан (7:3). Один из вариантов окисление 1,2-диметоксиэтана
- 13. Качественный анализ Качественным анализом обнаружено присутствие пероксида после циклирования фосфата ванадия лития. Это подтверждает то, что
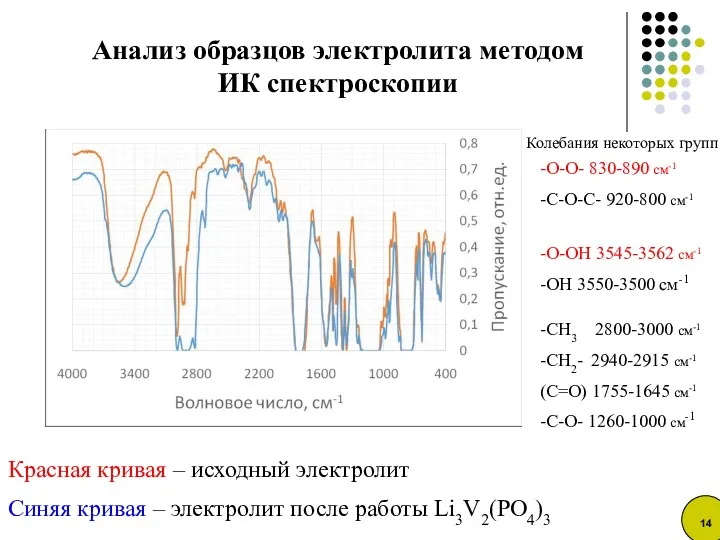
- 14. Красная кривая – исходный электролит Синяя кривая – электролит после работы Li3V2(PO4)3 Анализ образцов электролита методом
- 15. Выводы Рассмотрены возможные причины проблемы совместной работы электродов в электрохимической системе : (-) Li4Ti5O12 | 1M
- 17. Скачать презентацию






 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті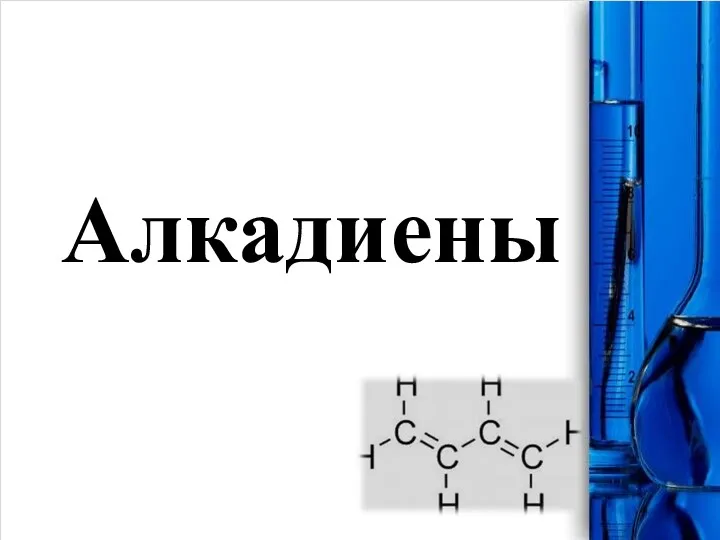 Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё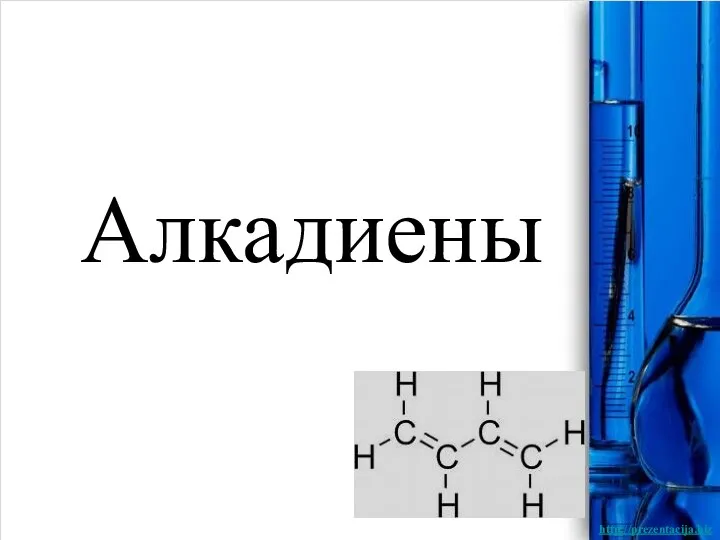 Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1