Содержание
- 2. КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных
- 3. Слово коррозия происходит от латинского «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание»). Коррозия вызывается химической реакцией
- 5. Химическая коррозия 0 +4 0 t +3 +6 -2 2 Fe+ 3 SO2 + 3 O2
- 6. Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая не позволяет окислителям проникнуть в
- 7. Электрохимическая коррозия Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Металлы
- 8. Рассмотрим разрушение железного образца в присутствии примеси олова. 1. В кислой среде: На железе, как более
- 9. 2. В щелочной или нейтральной среде: Fe 0 – 2e ? Fe 2+ (на аноде) O20
- 10. В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать
- 11. Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает
- 12. Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
- 13. Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности
- 14. Значительно усиливает коррозию повышение температуры
- 15. Зимой для удаления снега и льда с тротуаров используют техническую соль. Образующиеся растворы создают благоприятную среду
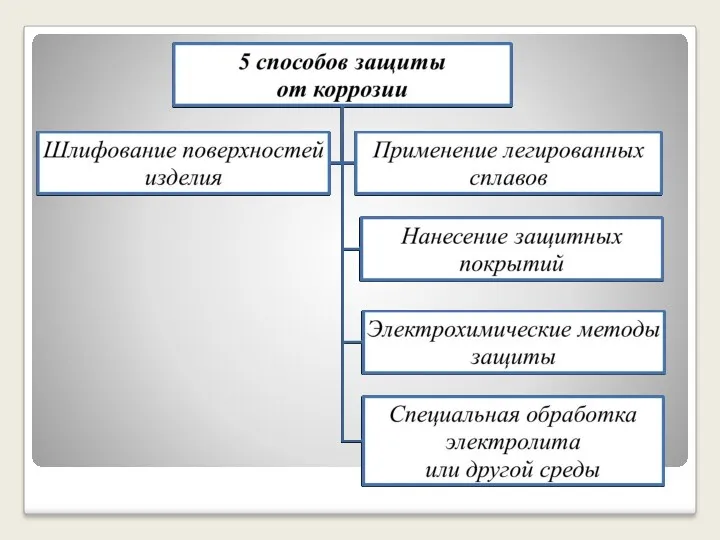
- 17. Способы защиты от коррозии
- 19. 1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные
- 20. 3.Нанесение защитных покрытий Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато
- 21. Металлические – это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные плёнки.
- 22. 4. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют кусочек более активного металла
- 23. Введение веществ - ингибиторов, замедляющих коррозию. Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении
- 25. Скачать презентацию





















 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов История мыловарения
История мыловарения Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Химия и живопись
Химия и живопись Щелочноземельные металлы
Щелочноземельные металлы Петрография некоторых распространенных метаморфических пород
Петрография некоторых распространенных метаморфических пород Органика вокруг нас
Органика вокруг нас Аммиак: состав вещества, получение, применение, строение, свойства
Аммиак: состав вещества, получение, применение, строение, свойства Поверхностно-активные вещества
Поверхностно-активные вещества Бумажная и тонкослойная хроматография
Бумажная и тонкослойная хроматография Аминокислоты. Производные карбоновых кислот,
Аминокислоты. Производные карбоновых кислот, Открытие хлора
Открытие хлора Спирты
Спирты Источники низших олефинов
Источники низших олефинов Алкены. состав и строение, свойства
Алкены. состав и строение, свойства Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Природный газ
Природный газ Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Липиды. Классификация
Липиды. Классификация Фенол. Феноловая катастрофа
Фенол. Феноловая катастрофа Алкены. Номенклатура. Строение молекулы
Алкены. Номенклатура. Строение молекулы Су - тіршілік көзі
Су - тіршілік көзі Сложные эфиры. Жиры
Сложные эфиры. Жиры Предмет органической химии
Предмет органической химии