Содержание
- 2. Задание 1 Вставь недостающие слова: Название химического элемента «азот» в переводе на русский язык означает _________
- 3. "С биологической точки зрения азот более ценен, чем любой драгоценный металл" В. А. Омелянский
- 4. Аммиак
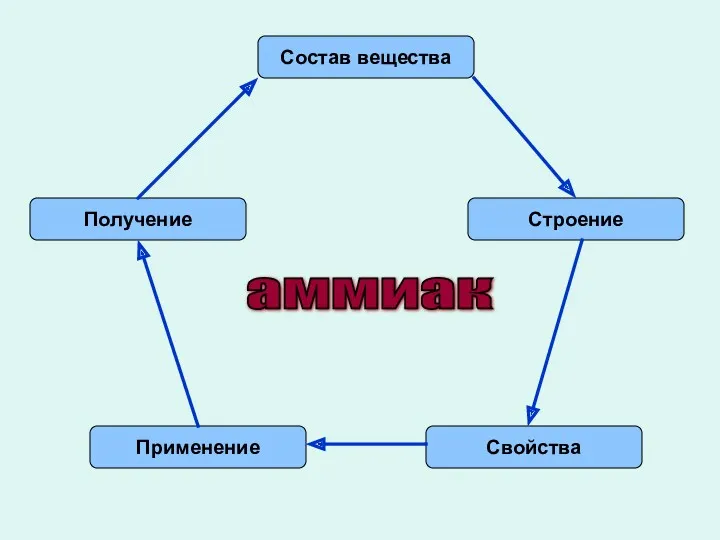
- 5. Состав вещества Строение Свойства Применение Получение аммиак
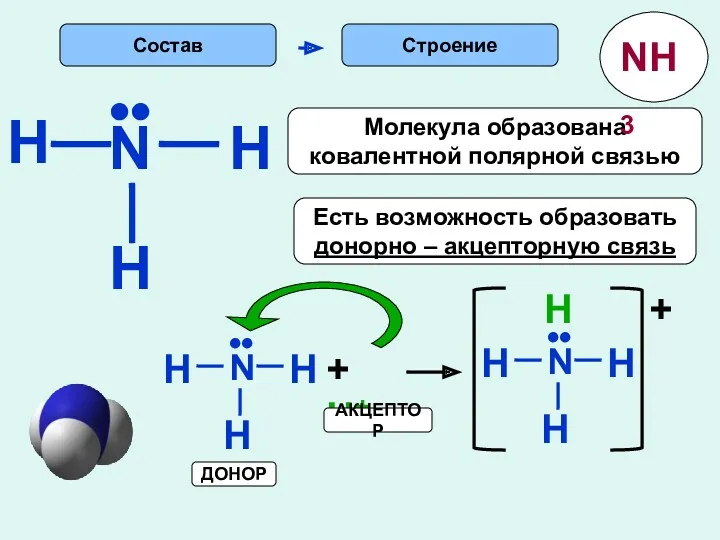
- 6. H Строение N H H •• Есть возможность образовать донорно – акцепторную связь Молекула образована ковалентной
- 7. Задание: а)прочитайте на странице 212 механизм образования донорно-акцепторной связи. Б) запишите механизм образования донорно-акцепторной связи между
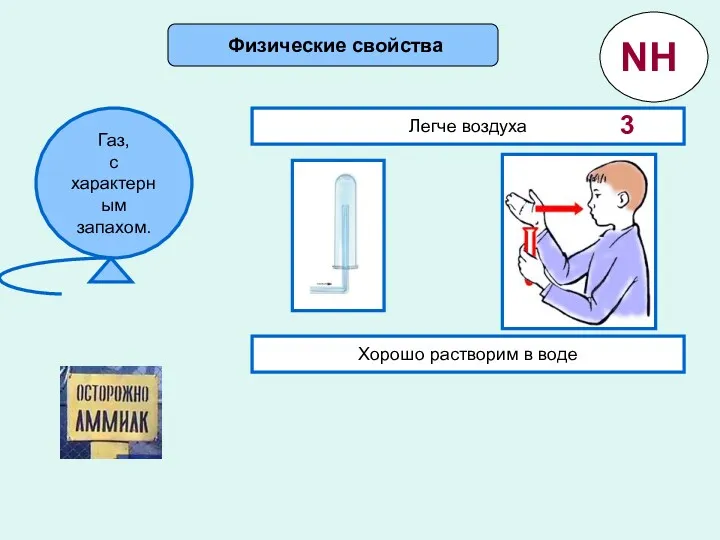
- 8. Физические свойства Легче воздуха Хорошо растворим в воде
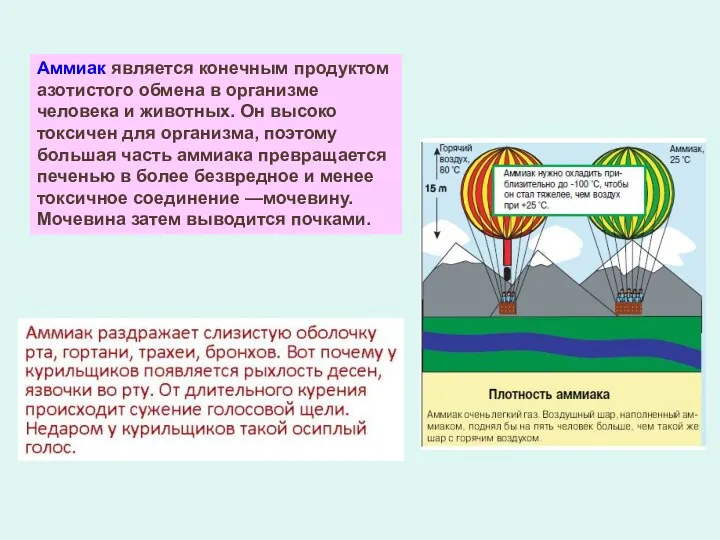
- 9. Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он высоко токсичен для организма,
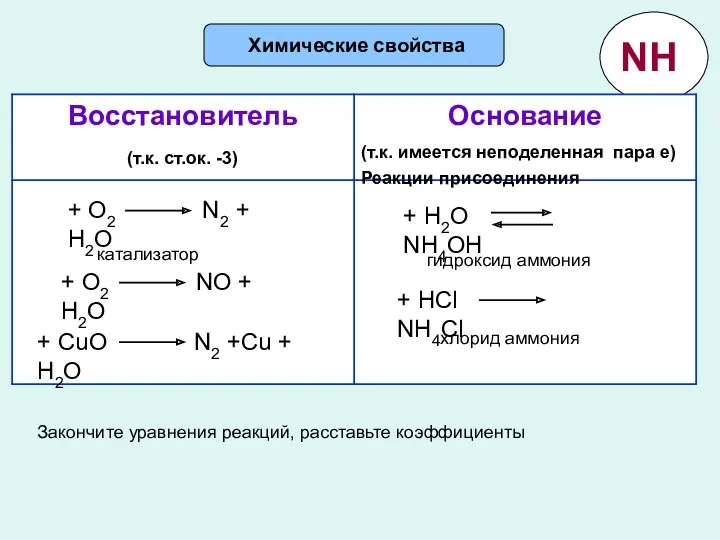
- 10. Химические свойства (т.к. ст.ок. -3) (т.к. имеется неподеленная пара е) Реакции присоединения гидроксид аммония хлорид аммония
- 11. Задание: Закончите уравнения реакций: NH3 + H2SO4 = 2NH3 + H2SO4 = NH3 + H3PO4 =
- 12. ПРОВЕРЬ СЕБЯ! NH3 + H2SO4 = NH4HSO4 2NH3 + H2SO4= (NH4)2SO4 NH3 + H3PO4 = NH4H2PO4
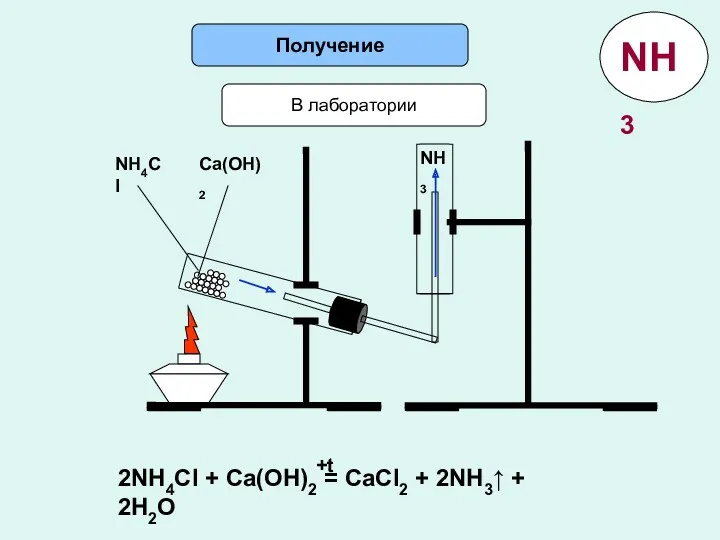
- 13. Получение В лаборатории NH4Cl Ca(OH)2 NH3
- 14. В промышленности Получение Смесь азота и водорода турбокомпрессор катализатор теплообменник холодильник сепаратор NH3
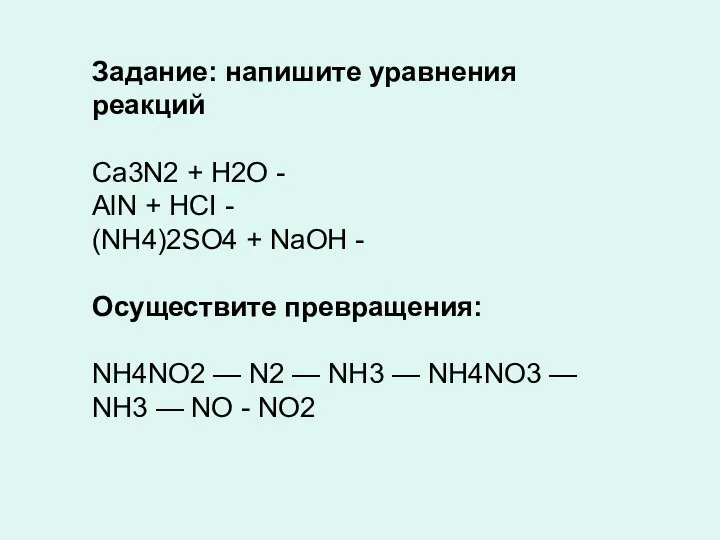
- 15. Задание: напишите уравнения реакций Ca3N2 + H2O - AlN + HCI - (NH4)2SO4 + NaOH -
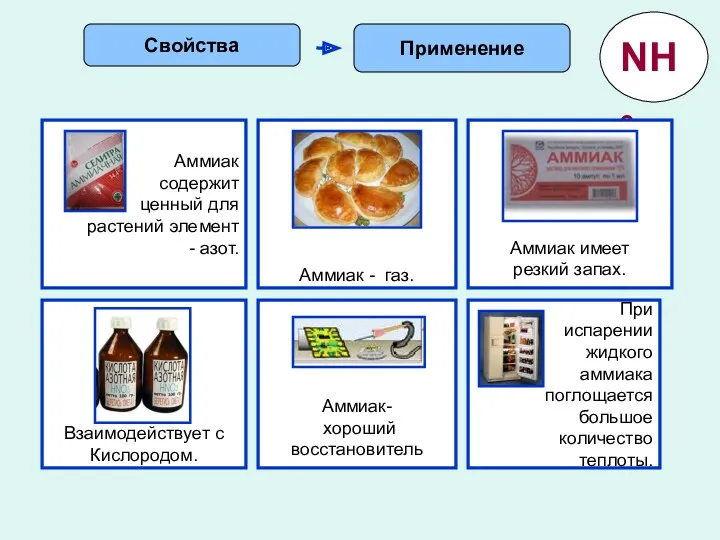
- 16. Применение Свойства
- 17. Прочитайте опыт 2 стр.263
- 18. 14.01.19
- 19. Задание п.30 выписать физические свойства солей аммония . Записать качественную реакцию на катион аммония (стр.217) Выписать
- 20. 14.01.19
- 22. Скачать презентацию











 Вчення про розчини. Рівновага в розчинах електролітів
Вчення про розчини. Рівновага в розчинах електролітів Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Гидроксид магния
Гидроксид магния Ациклические углеводороды
Ациклические углеводороды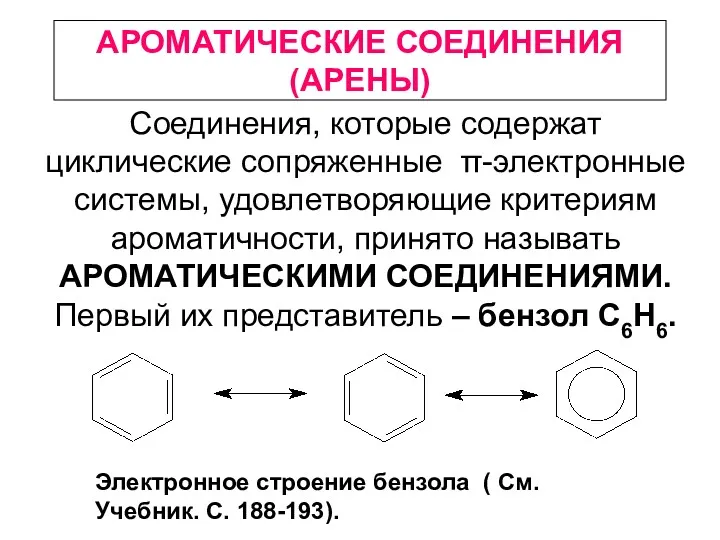 Ароматические соединения (арены)
Ароматические соединения (арены) Строение атома и периодический закон
Строение атома и периодический закон Альдольные реакции енолятов
Альдольные реакции енолятов Железо и его свойства
Железо и его свойства Теоретические основы количественного анализа
Теоретические основы количественного анализа Стоматологические материалы на основе полимеров
Стоматологические материалы на основе полимеров Железо и его соединения
Железо и его соединения Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Строение атома углерода
Строение атома углерода Химия и производство
Химия и производство Франций (Francium)
Франций (Francium) Полисахариды. Крахмал
Полисахариды. Крахмал Оксидтер
Оксидтер Полибутадиен
Полибутадиен Альдегиды и кетоны. Определение
Альдегиды и кетоны. Определение Металлы
Металлы Природные источники углеводородов
Природные источники углеводородов Введение в органическую химию
Введение в органическую химию Что нас объединяет?
Что нас объединяет? Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов 20231009_zhyostkost_vody
20231009_zhyostkost_vody Физические свойства минералов
Физические свойства минералов Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Вода
Вода