Содержание
- 2. Тема: 1. Роль води і розчинів у біології та медицині. Загальні відомості про розчини. 2. Механізм
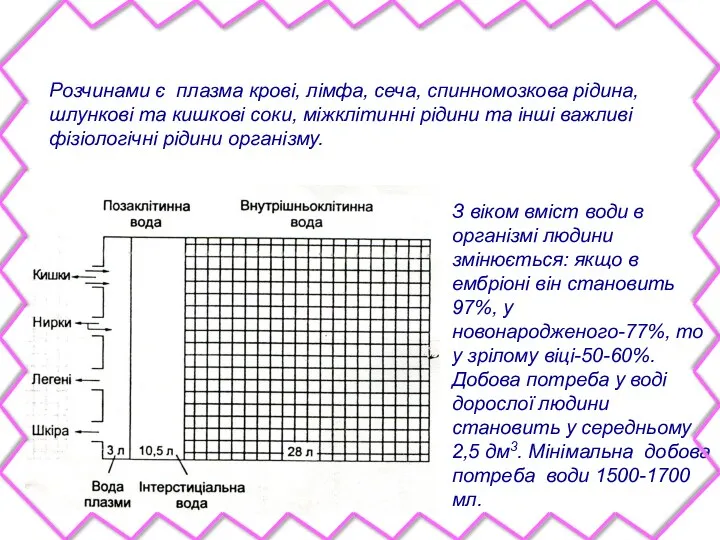
- 3. Розчинами є плазма крові, лімфа, сеча, спинномозкова рідина, шлункові та кишкові соки, міжклітинні рідини та інші
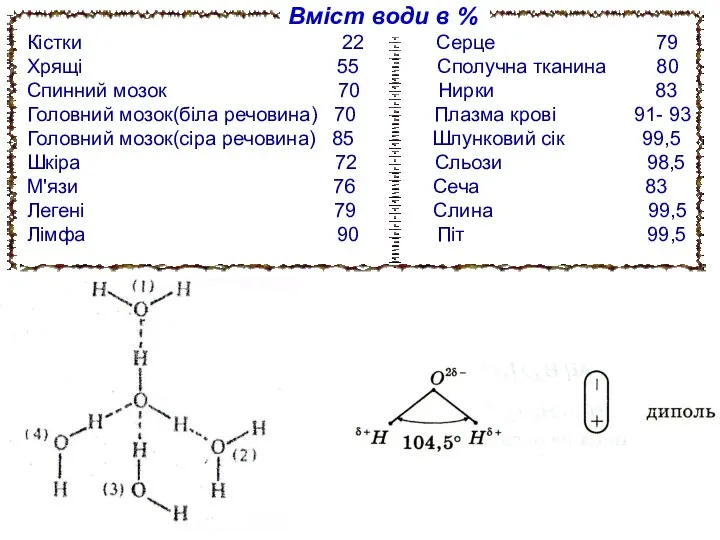
- 4. Вміст води в % Кістки 22 Серце 79 Хрящі 55 Сполучна тканина 80 Спинний мозок 70
- 5. Розчин - це гомогенна(однорідна) термодинамічна, фізико-хімічна система змінного складу, що складається з розчинника та розчинених речовин
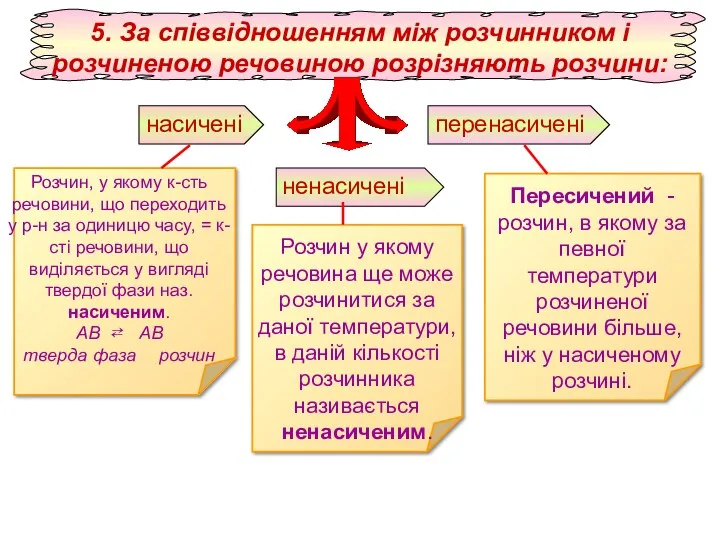
- 6. 5. За співвідношенням між розчинником і розчиненою речовиною розрізняють розчини׃ насичені ненасичені перенасичені Розчин, у якому
- 8. Процес розчинення розчинення (H2SO4) розчинена речовина-------------------→ речовина в розчині ±Q ← кристалізація (NH4Cl) Рівновага – насичений
- 9. 3) розподіл сольватованих часток у об'ємі розчинника-дифузія. Процес розчинення – це складний фізико-хімічний процес. Сучасна теорія
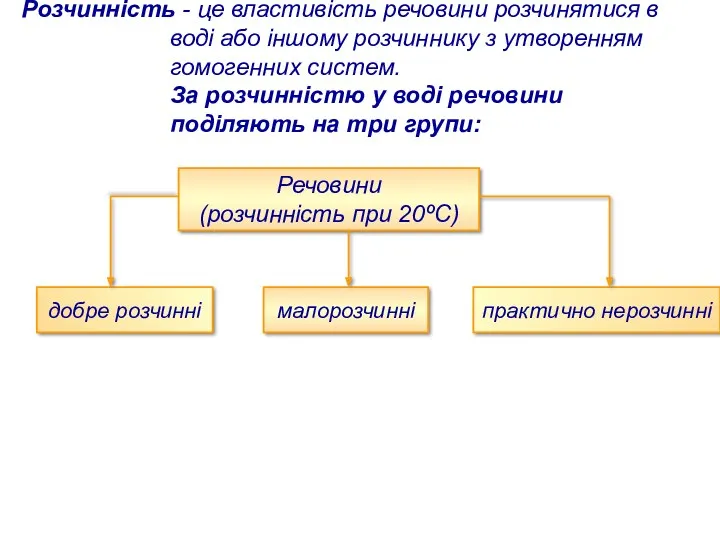
- 10. Розчинність - це властивість речовини розчинятися в воді або іншому розчиннику з утворенням гомогенних систем. За
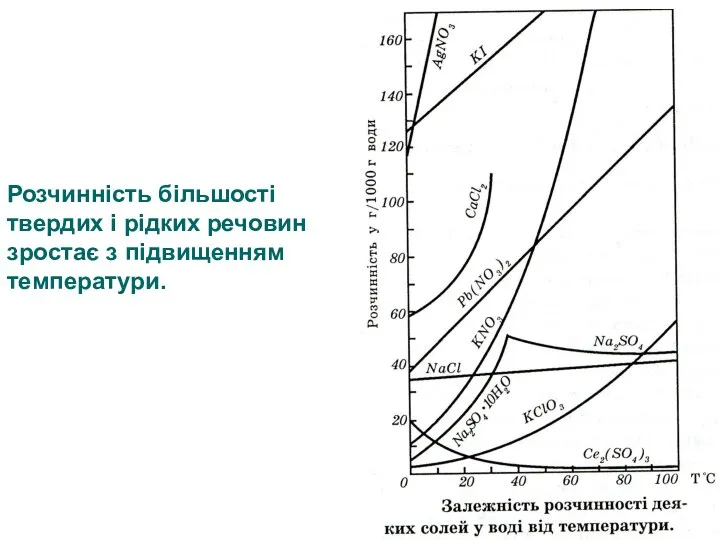
- 11. Розчинність залежить від природи реагуючих речовин, температури і тиску. Залежність розчинності від природи реагуючих речовин можна
- 12. Розчинність більшості твердих і рідких речовин зростає з підвищенням температури.
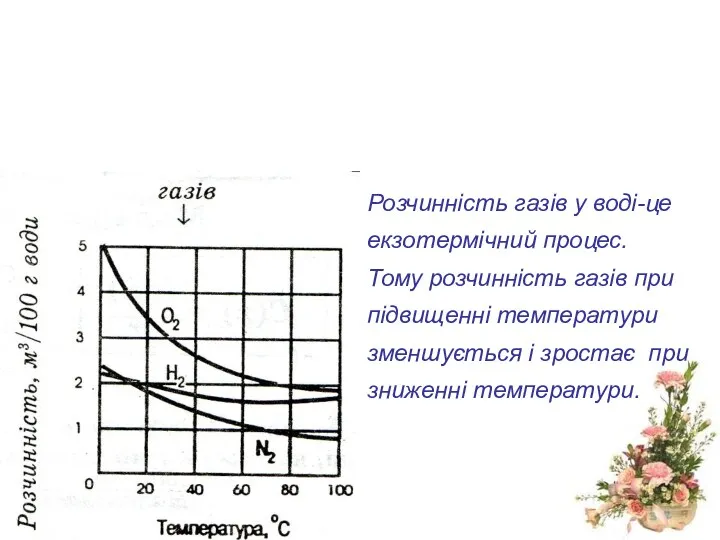
- 13. Розчинність газів у воді-це екзотермічний процес. Тому розчинність газів при підвищенні температури зменшується і зростає при
- 14. Тиск впливає лише на розчинність газів. Згідно принципу Ле-Шательє зростання тиску та пониження температури сприяє розчинності
- 15. Зміна розчинності газів під впливом тиску здатна викликати важку патологію людського організму. Кесонна хвороба – патологічний
- 16. Властивості розчинів нелетких речовин, які залежать тільки від числа частинок у розчині, а не від їх
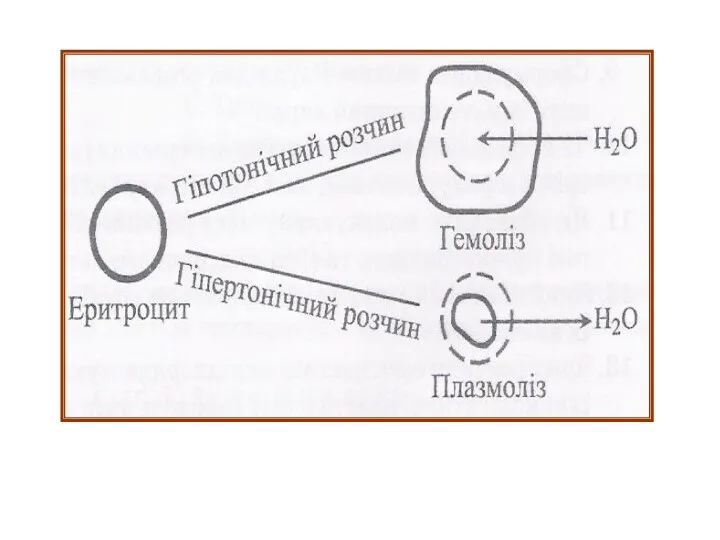
- 17. Такі властивості характерні для стінок клітин живих організмів - кишечника, сечового міхура, шкіри, протоплазми. Процес односторонньої
- 18. Явище осмосу має велике значення для біологічних систем. Кров, лімфа, а також всі тканинні рідини живих
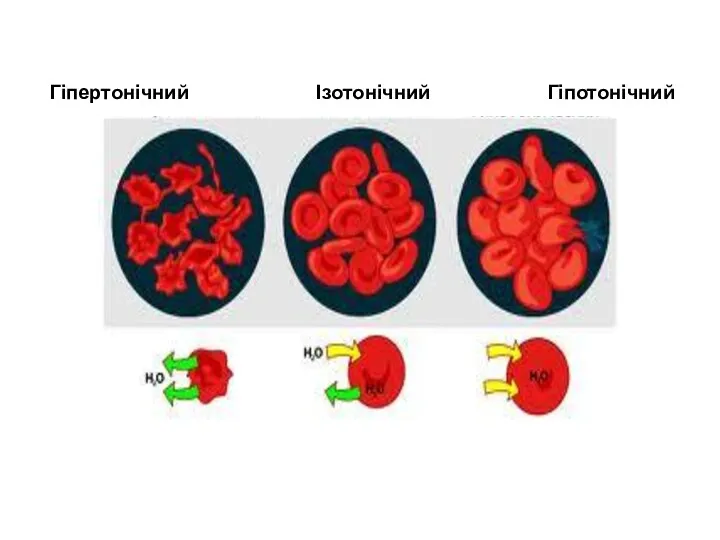
- 19. Розчин з осмотичним тиском,що дорівнює осмотичному тиску розчину, прийнятого за стандарт називають ізотонічним розчином. В медичній
- 21. Гіпертонічний Ізотонічний Гіпотонічний
- 22. Масова частка (масова, процентна концентрація) - величина, що показує скільки г розч. р-ни міститься в 100г
- 23. √ СМ=------(моль/л) V де √ - число моль розчиненої речовини V - об’єм розчину, дм3 Розчини,
- 24. Електроліти Неелектроліти Речовини Електролітична дисоціація – розпад електроліту на йони під час розчинення його в воді
- 25. Електролітний склад позаклітинної та внутрішньоклітинної рідин неоднаковий, але дотримується принцип електронейтральності, тобто сумарна концентрація катіонів =
- 26. де n – число дисоційованих молекул, N – загальне число молекул електроліту, СДис – концентрація молекул,
- 28. Дисоціація одноосновних кислот: НАn⇄Н+ + Аn‾. Математичний вираз константи рівноваги процесу дисоціації: [Н+][ Аn‾] Кд =
- 29. Сα2 Кд =--------. 1- α Зв'язок між константою дисоціації, ступенем дисоціації і молярною концентрацією розчину встановив
- 30. В 1л води за t0 250 С дисоціює 10-7 моль води, утворюється 10-7 моль/л йонів Н+,
- 31. Співвідношення між реакцією середовища, концентраціями йонів і значенням рН мають вигляд: нейтральне середовище [Н+]=[ОН-]=10-7, рН=7 кисле
- 32. Кислотно-основний стан крові Зміщення кислотно-оснóвного стану крові в напрямку підвищення концентрації йонів гідроксонію, називають ацидозом, а
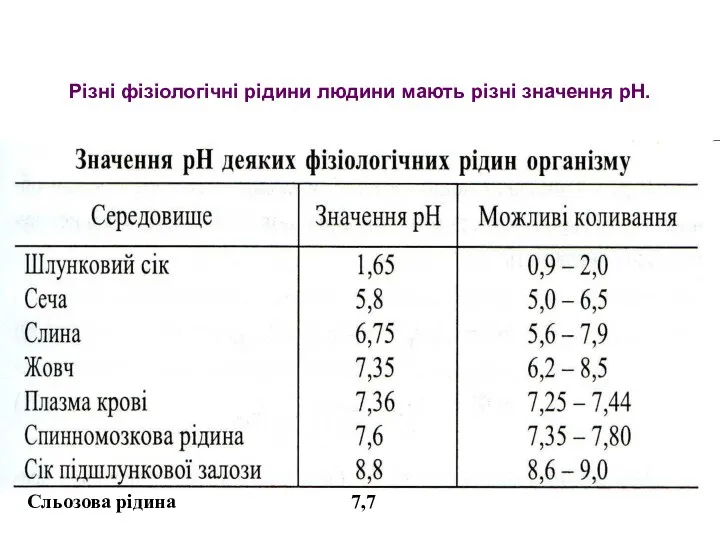
- 33. Різні фізіологічні рідини людини мають різні значення рН. Сльозова рідина 7,7
- 34. До біологічних буферних систем належать чотири типи буферних розчинів: Кров відіграє значну роль у підтриманні кислотно-лужного
- 35. ферм. С12Н22О11 + Н2О-------→С6Н12О6 + С6Н12О6; Сахароза Глюкоза Фруктоза (С6Н10О5)n → (С6Н10О5)х → С12Н22О11 → С6Н12О6;
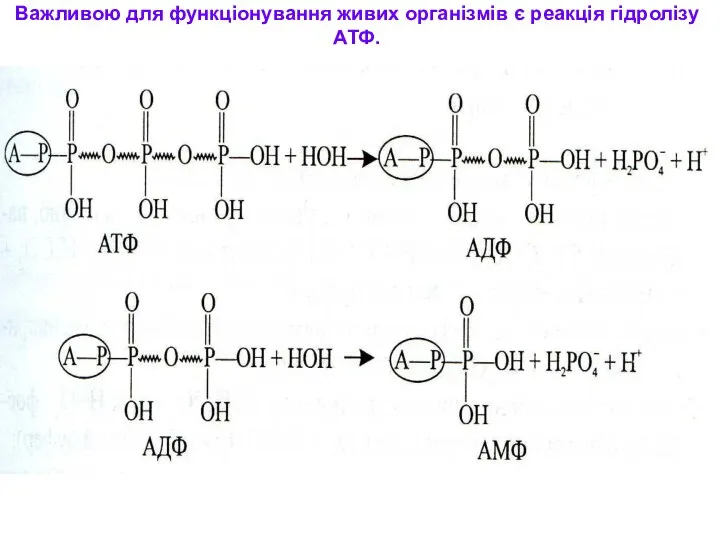
- 36. Важливою для функціонування живих організмів є реакція гідролізу АТФ.
- 37. Електролітний (йонний) склад, рН і осмотичний тиск - основні параметри рідин організму, які підтримуються постійними за
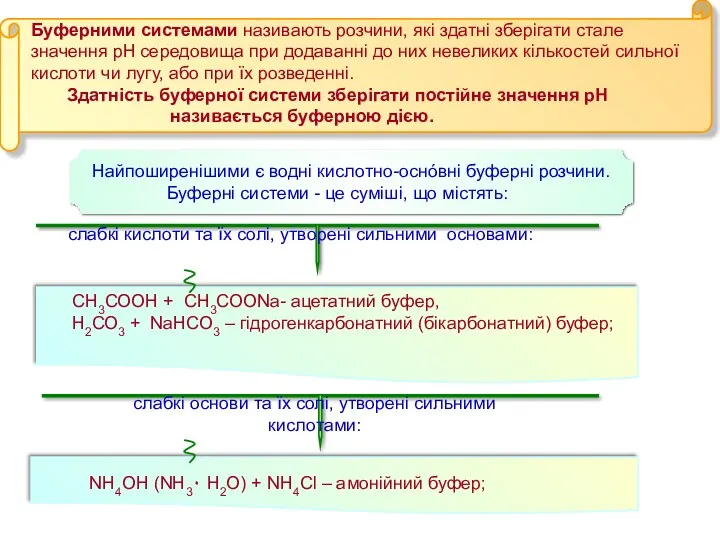
- 38. Буферними системами називають розчини, які здатні зберігати стале значення рН середовища при додаванні до них невеликих
- 39. сильна або слабка кислота(кислотний компонент) і гліцин – НCl + NH2CH2COOH солі багатоосновних слабких кислот: NaН2РО4
- 40. Завдання додому: Музиченко В.П. та ін. Медична хімія. С.23-74 Методматеріали для ПСРС.
- 41. 3.Укажіть ряд, у якому наведено тільки катіони, що входять до складу плазми крові: А. Cl‾, НСО3‾,
- 43. Скачать презентацию





























 Carbohydrates (sugars)
Carbohydrates (sugars) Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Алюминий. Строение
Алюминий. Строение Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Коллигативные свойства растворов
Коллигативные свойства растворов Элементы теории горения
Элементы теории горения Physiology lab
Physiology lab Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Высокомолекулярные соединения
Высокомолекулярные соединения Сахароза
Сахароза Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Соединения железа
Соединения железа Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Значение органической химии в жизни человека
Значение органической химии в жизни человека Степень окисления в органической химии
Степень окисления в органической химии Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Ионная связь
Ионная связь Строение атома
Строение атома Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химический элемент титан
Химический элемент титан