Содержание
- 2. Задачи урока: Изучить положение металлов в периодической системе Изучить физические свойства Изучить химические свойства Изучить области
- 3. Девиз урока: «Мощь и сила науки – во множестве фактов, цель – в обобщении этого множества»
- 4. Загадочная пауза Он в теченье многих лет был причиной многих бед. Был металл серебристо-белым, в соединении
- 5. «metallon» (греч.) – земляные работы, раскопки, шахта, рудник, руда. «metallum» (лат.) – руда и выплавляемый из
- 6. Характеристика химических элементов - металлов M+? Отдают от 1 до 3 электронов (исключение – металлы главных
- 7. Малое количество электронов на внешнем слое (в основном от 1 до 3) и сравнительно большие радиусы
- 8. Распространенность металлов в земной коре 8,05 % 4,65 % 2,96 % 2,50 % 2,50 % 1,87
- 9. Загадочная пауза Самый распространенный в земной коре металл. Металл, обнаруженный в упавших метеоритах. Металл, обладающий бактерицидными
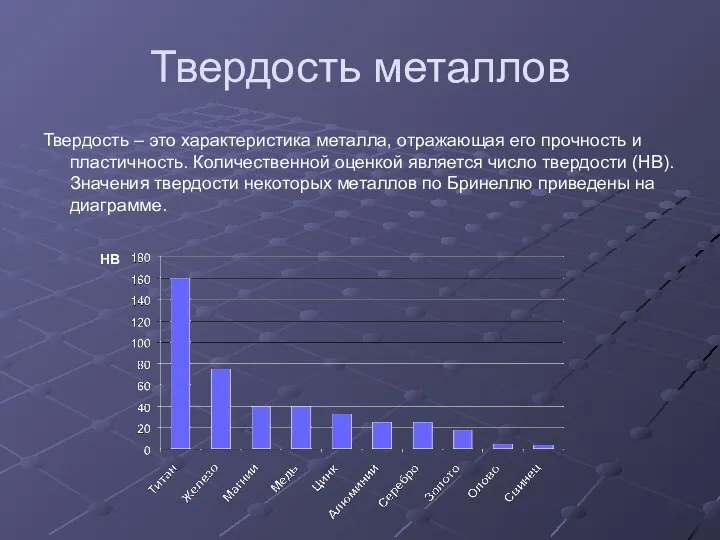
- 10. Твердость металлов Твердость – это характеристика металла, отражающая его прочность и пластичность. Количественной оценкой является число
- 11. натрий хранят в запаянных ампулах, или под слоем керосина, поскольку на воздухе натрий взаимодействует с водяными
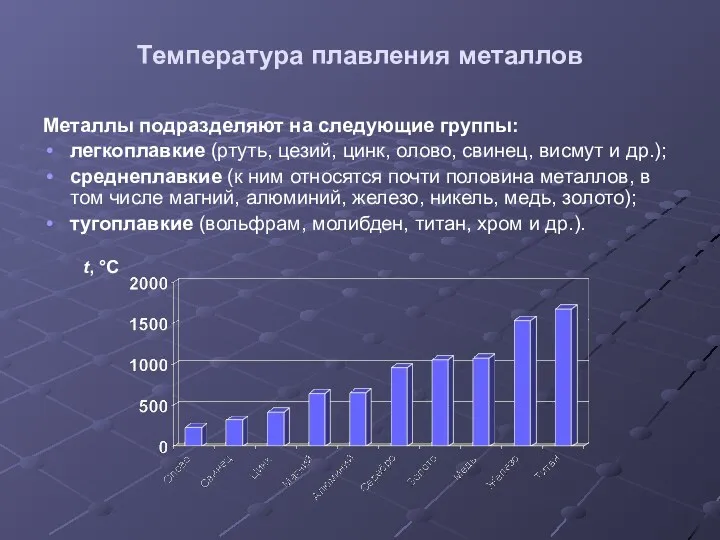
- 12. Температура плавления металлов Металлы подразделяют на следующие группы: легкоплавкие (ртуть, цезий, цинк, олово, свинец, висмут и
- 13. Металл галлий, твердый слиток которого лежит на столе, имеет низкую температуру плавления и становится жидким от
- 14. Тонкие вольфрамовые спирали, раскаленные электрическим током, рождают свет лампочек накаливания. На снимке лампочка лежит на образцах
- 15. Эти произведения прикладного искусства, выполненные из металлов, найдены при раскопках. Они были сделаны руками мастеров, тонко
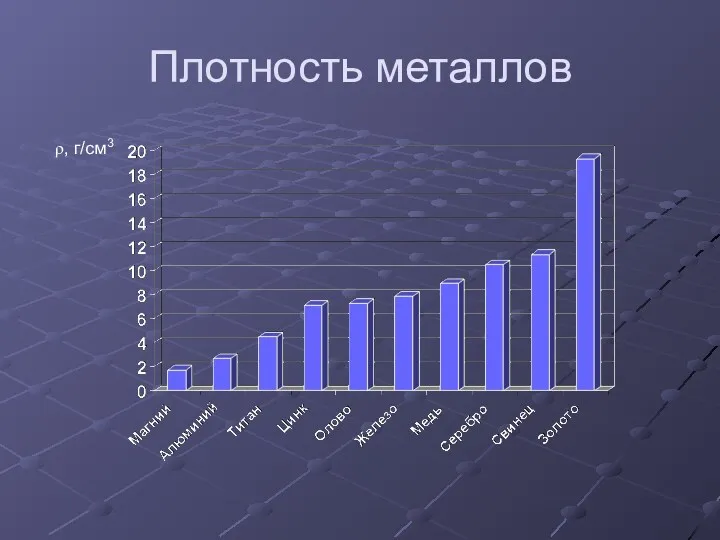
- 16. Плотность металлов ρ, г/см3
- 17. Многообразие металлов Алюминий Видео Железо МедьМедь видео ОловоОлово видео Золото
- 18. Химические «перевертыши» Разговор – ртуть, крик – платина. (Слово – серебро, молчание – золото.) Гладь металл,
- 19. Оксиды Степень окисления +1, +2 +3 +4, +5 Основные оксиды: M2O, MO Амфотерные оксиды: M2O3 Кислотные
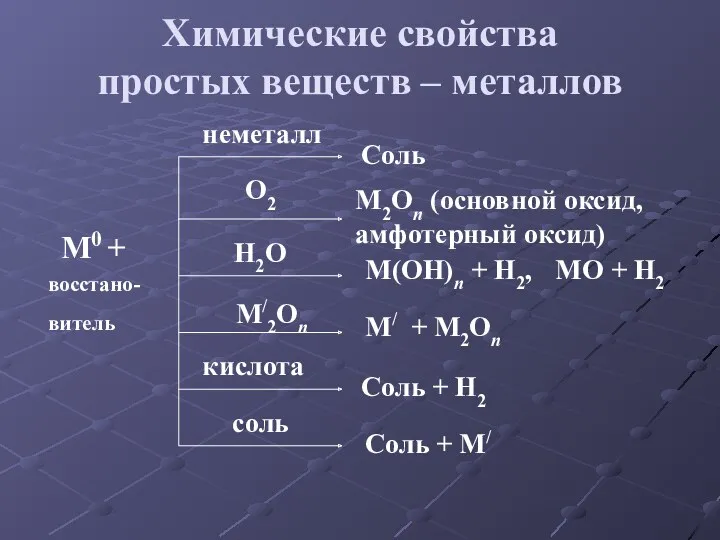
- 20. Химические свойства простых веществ – металлов M0 + восстано-витель неметалл O2 H2O M/2On кислота соль Cоль
- 21. Какой металл самый-самый? Самый легкий металл – Li (ρ =0,53 г/см3). Самый тяжелый металл – Os
- 22. Решите задачу Некий жилец второго подъезда пришел в гости в квартиру № 8 поиграть в шахматы.
- 23. Химическая викторина Какой самый распространённый металл на Земле? Самый древний сплав Каким расплавленным металлом можно заморозить
- 25. Скачать презентацию


















 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Кремний и его соединения
Кремний и его соединения Водородная связь
Водородная связь Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Органическая химия. Вещества
Органическая химия. Вещества Магматизм. (Лекция 6)
Магматизм. (Лекция 6)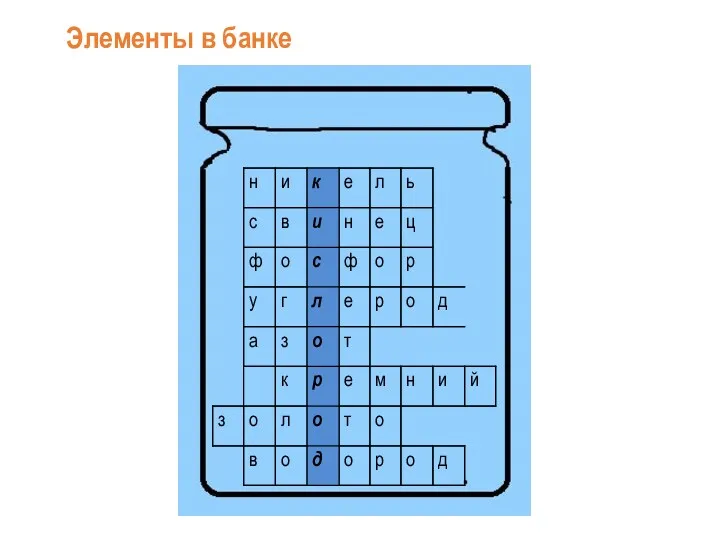 Кислород
Кислород Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів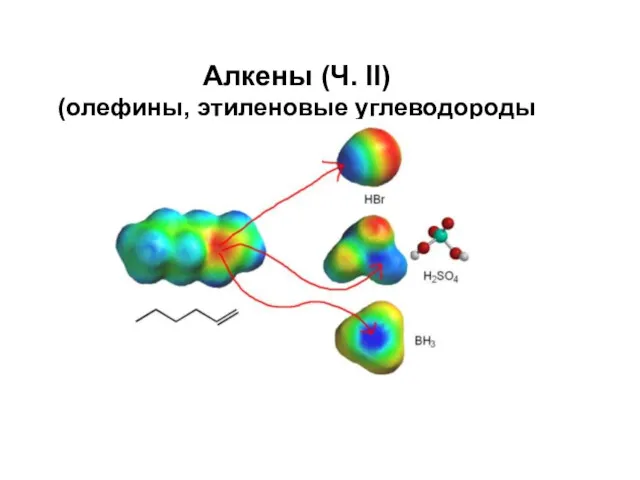 Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Прочность полимеров
Прочность полимеров Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Буферные растворы
Буферные растворы Місце хімії серед наук про природу
Місце хімії серед наук про природу Химические волокна
Химические волокна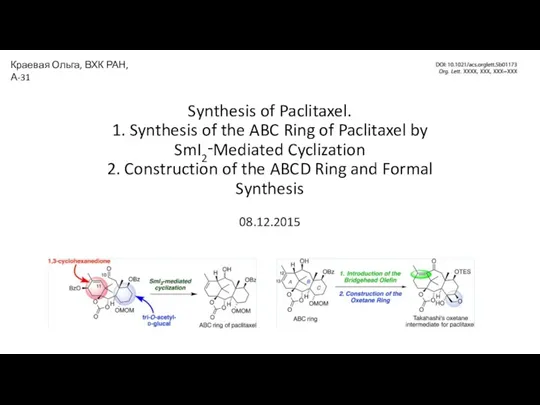 Synthesis of Paclitaxel
Synthesis of Paclitaxel Строение атома. 8 класс
Строение атома. 8 класс Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Витамины. Ашылу тарихы
Витамины. Ашылу тарихы ГИА-9 Химия. А4
ГИА-9 Химия. А4 Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Рідкі кристали
Рідкі кристали Спирты
Спирты Химические уравнения
Химические уравнения Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Применение алюминия и его сплава в машиностроении
Применение алюминия и его сплава в машиностроении Химическая связь. 8 класс
Химическая связь. 8 класс