Содержание
- 2. С какими из перечисленных веществ будет реагировать гидроксид натрия, а с какими соляная кислота? Вещества: HNO3,
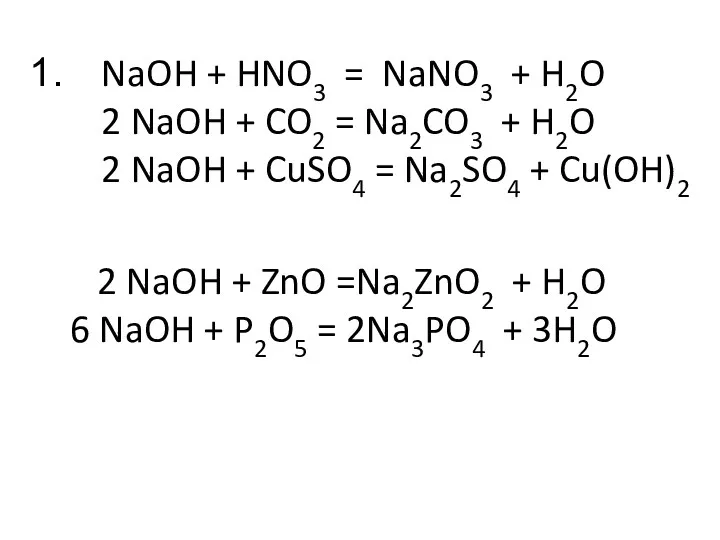
- 3. NaOH + HNO3 = NaNO3 + H2O 2 NaOH + CO2 = Na2CO3 + H2O 2
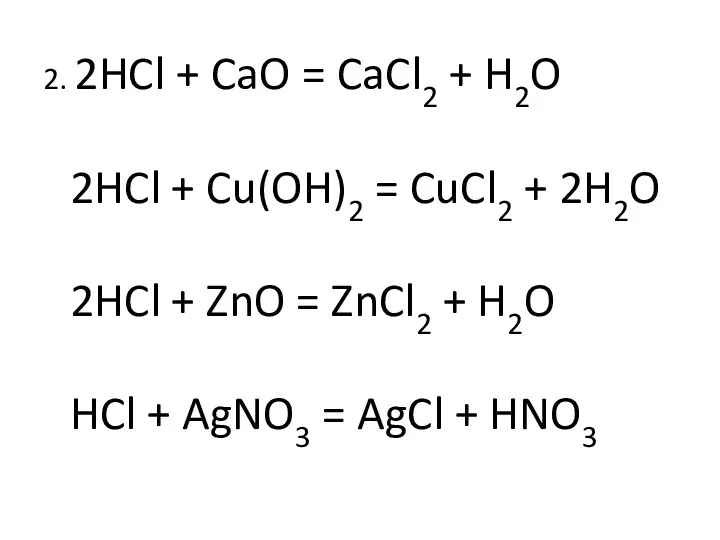
- 4. 2. 2HCl + CaO = CaCl2 + H2O 2HCl + Cu(OH)2 = CuCl2 + 2H2O 2HCl
- 5. Амфотерные соединения проявляют одновременно и основные, и кислотные свойства
- 6. Какие элементы образуют эти соединения? Металлы в степени окисления +3 и+4,а также металлы, металлические свойства которых
- 7. Физические свойства амфотерных гидроксидов Амфотерные гидроксиды – это нерастворимые в воде твердые вещества, как правило, белого
- 8. Получение Предположите способ получения амфотерных гидроксидов, помня, что они не растворимы в воде
- 9. Реакцией обмена между растворимой солью соответствующего металла и щелочью ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
- 11. Задание: получить гидроксид алюминия и определить его химические свойства есть растворы хлорида алюминия, аммиака, соляной кислоты
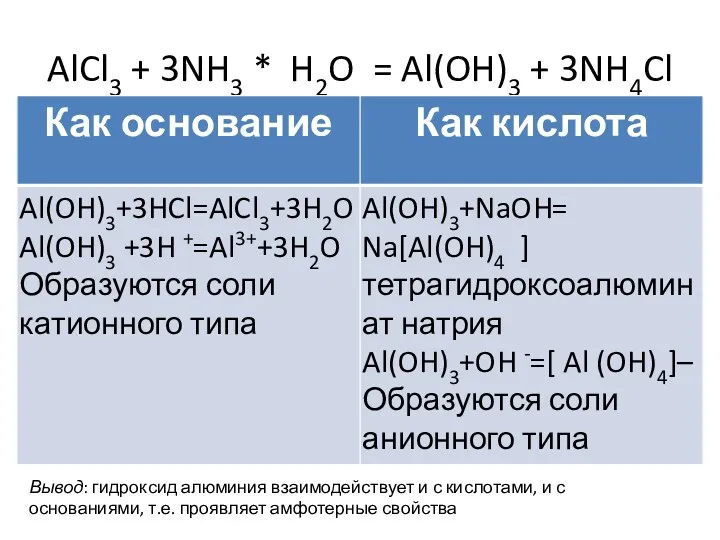
- 12. AlCl3 + 3NH3 * H2O = Al(OH)3 + 3NH4Cl Вывод: гидроксид алюминия взаимодействует и с кислотами,
- 13. В водных растворах амфотерные гидроксиды практически не диссоциируют, но в растворах кислот и щелочей могут диссоциировать
- 14. Соли анионного типа устойчивы в щелочной среде, но разрушаются при подкислении растворов Na [Al(OH)4 ]+4HCl=NaCl+AlCl3+4H2O
- 15. Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются: 2Al(OH )3 Al2O3 + 3H2O
- 16. Экспериментальная задача Даны три пробирки с растворами хлоридов натрия, магния и алюминия. Как определить, в какой
- 17. 1. NaCl2 + NaOH =/= реакция не идет 2. MgCl2 + 2NaOH = Mg (OH)2 +
- 18. Осуществить превращения Вариант 1 Al-1- Al2O3 -2-- NaAlO2 -3-- Al (OH)3 -4-Al2O3 Вариант 2 AlCl3 --1--
- 19. 1. 4Al + 3O2 = 2Al2O3 2. Al2O3 + Na2O 2NaAlO2 3. NaAlO2 + HCl +
- 21. Скачать презентацию









![Соли анионного типа устойчивы в щелочной среде, но разрушаются при подкислении растворов Na [Al(OH)4 ]+4HCl=NaCl+AlCl3+4H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/613446/slide-13.jpg)





 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості